
- •Лекція 1: Предмет та основні поняття аналітичної хімії. Мета: Засвоїти предмет та основні поняття аналітичної хімії.
- •1. Основні поняття аналітичної хімії
- •2. Основні вимоги до аналітичних реакцій
- •3. Контрольні питання
- •1. Основні поняття аналітичної хімії
- •2. Основні вимоги до аналітичних реакцій
- •3. Контрольні питання
- •Лекція 2-3: Теоретичні основи аналітичної хімії. Мета: Засвоїти теоретичні основи аналітичної хімії.
- •1. Іонний добуток води та рН середовища
- •2. Буферні розчини
- •3. Розчинність малорозчинних сполук та добуток розчинності
- •4. Способи вираження концентрацій в аналітичній хімії
- •3. Контрольні питання
- •Лекція 4: Якісний аналіз.Кислотно-основна класифікація катіонів та аніонів Мета: Засвоїти кислотно-основну класифікація катіонів та аніонів
- •Кислотно-основна класифікація катіонів
- •2. Поділ аніонів на аналітичні групи
- •3. Основні визначення
- •Лекція 5: Кількісний аналіз. Гравіметричний метод аналізу. Мета: Засвоїти предмет та основні поняття аналітичної хімії.
- •1. Хімічні методи кількісного аналізу
- •2. Гравіметричний метод аналізу
- •Лекції 6-7: Титриметричний аналіз. Мета: Засвоїти основни титриметрії.
- •Мірні колби, мірні циліндри, піпетки.
- •Блок автоматичного титрування.
- •2. Метод нейтралізації
- •Титрування сильної кислоти лугом (або навпаки).
- •Титрування слабкої кислоти лугом.
- •Титрування слабкої основи сильною кислотою.
- •Титрування слабкої кислоти слабкою основою.
- •3. Метод оксидиметрії
- •4. Інші методи титриметрії
- •5. Контрольні питання
- •Лекція 8: Основні принципи та класифікація фізико-хімічних методів аналізу. Визначення густини. Мета: Засвоїти принципи та класифікацію фізико-хімічних методів аналізу.
- •1. Основні принципи фізико-хімічних методів аналізу
- •2. Класифікація фізико-хімічних методів аналізу.
- •3. Визначення густини.
- •Визначення густини за допомогою ареометра та ареометр з вмонтованим термометром.
- •Визначення температури плавлення та кипіння.
- •Лекція 9: Рефрактометрія, поляриметрія. Мета: Засвоїти основи рефрактометрії та поляриметрії.
- •Поляриметрія.
- •Лекція 10: Атомно-емісійний спектральний аналіз. Мета: Засвоїти принципи атомно-емісійного спектрального аналізу.
- •1. Основні принципи атомно-емісійного спектрального аналізу.
- •2. Принципова схема роботи полуменевого фотометра.
- •Лекція 11: Атомно-абсорбційний аналіз. Мета: Засвоїти принципи атомно-абсорбційного аналізу.
- •1. Основні принципи атомно-абсорбційного спектрального аналізу.
- •2. Принципова схема роботи атомно-абсорбційного спектрофотометра.
- •3. Практичне застосування методу.
- •Лекція 12: Фотометричний аналіз. Метод молекулярної абсорбції. Мета: Засвоїти основи фотометричного аналізу (метод молекулярної абсорбції).
- •Лекція 13: Фотометричний аналіз. Турбидиметрія, нефелометрія; люмінесцентний аналіз (флуориметрія). Мета: Засвоїти основи фотометричного аналізу (турбидиметрії, нефелометрії та флуориметрії).
- •Люмінесцентний аналіз
- •Флуориметри.
- •Явище люмінесценції
- •Лекція 14: Потенціометрія та потенціометричне титрування. Мета: Засвоїти основи потенціометрії.
- •Хлор срібний, скляний електроди та йонселективні електроди.
- •Лекція 15: Кондуктометрія та кондуктометричне титрування. Мета: Засвоїти основи кондуктомтрії.
- •Лекція 16: Електрогравіметрія та кулонометрія. Мета: Засвоїти основи електрогравіметрії та кулонометрії.
- •Лекція 17: Хроматографія та мас хроматографія. Мета: Засвоїти основи хроматографії.
- •Лекція 9: Рефрактометрія, поляриметрія. Мета: Засвоїти основи рефрактометрії та поляриметрії.
- •Поляриметрія.
- •Лекція 10: Атомно-емісійний спектральний аналіз. Мета: Засвоїти принципи атомно-емісійного спектрального аналізу.
- •1. Основні принципи атомно-емісійного спектрального аналізу.
- •2. Принципова схема роботи полуменевого фотометра.
- •Лекція 11: Атомно-абсорбційний аналіз. Мета: Засвоїти принципи атомно-абсорбційного аналізу.
- •1. Основні принципи атомно-абсорбційного спектрального аналізу.
- •2. Принципова схема роботи атомно-абсорбційного спектрофотометра.
- •3. Практичне застосування методу.
- •Лекція 12: Фотометричний аналіз. Метод молекулярної абсорбції. Мета: Засвоїти основи фотометричного аналізу (метод молекулярної абсорбції).
- •Лекція 13: Фотометричний аналіз. Турбидиметрія, нефелометрія; люмінесцентний аналіз (флуориметрія). Мета: Засвоїти основи фотометричного аналізу (турбидиметрії, нефелометрії та флуориметрії).
- •Люмінесцентний аналіз
- •Флуориметри.
- •Явище люмінесценції
- •Лекція 14: Потенціометрія та потенціометричне титрування. Мета: Засвоїти основи потенціометрії.
- •Хлор срібний, скляний електроди та йонселективні електроди.
- •Лекція 15: Кондуктометрія та кондуктометричне титрування. Мета: Засвоїти основи кондуктомтрії.
- •Лекція 16: Електрогравіметрія та кулонометрія. Мета: Засвоїти основи електрогравіметрії та кулонометрії.
- •Лекція 17: Хроматографія та мас хроматографія. Мета: Засвоїти основи хроматографії.
3. Розчинність малорозчинних сполук та добуток розчинності
В аналітичній хімії багато реакцій пов’язано з утворенням осадів. Для того, щоб чутливість аналітичної реакції була високою, необхідно, щоб розчинність осаду була малою. Кількісно розчинність малорозчинних сполук виражають добутком розчинності. Який є фактично константою рівноваги між осадом та іонами малорозчинної сполуки що знаходиться в розчині.
Добуток розчинності – це константа, що характеризує розчинність малорозчинних електролітів. Позначають ДР.
Добуток розчинності визначається природою речовини та природою розчинника і залежить від температури. Значення ДР за температури 25°С можна знайти в довідниках з аналітичної хімії.
У загальному вигляді вираз ДР малорозчинного електроліту, що дисоціює за рівнянням:
AnBm n Am+ + mBn-
Має такий вигляд:
ДР (AnBm) = [Am+]n [Bn-]m
Виходячи з наведеного рівняння, можна записати вираз ДР для будь якого малорозчинного електроліту. Наприклад для кальцій фториду та ферум (+3) гідроксиду:

Знаючи добуток розчинності можна розрахувати розчинність малорозчинної сполуки в моль/л або в г/л. В формулі для ДР використовується молярна концентрація іонів у розчині.
Таблиця.1 Добуток розчинності деяких малорозчинних електролітів.
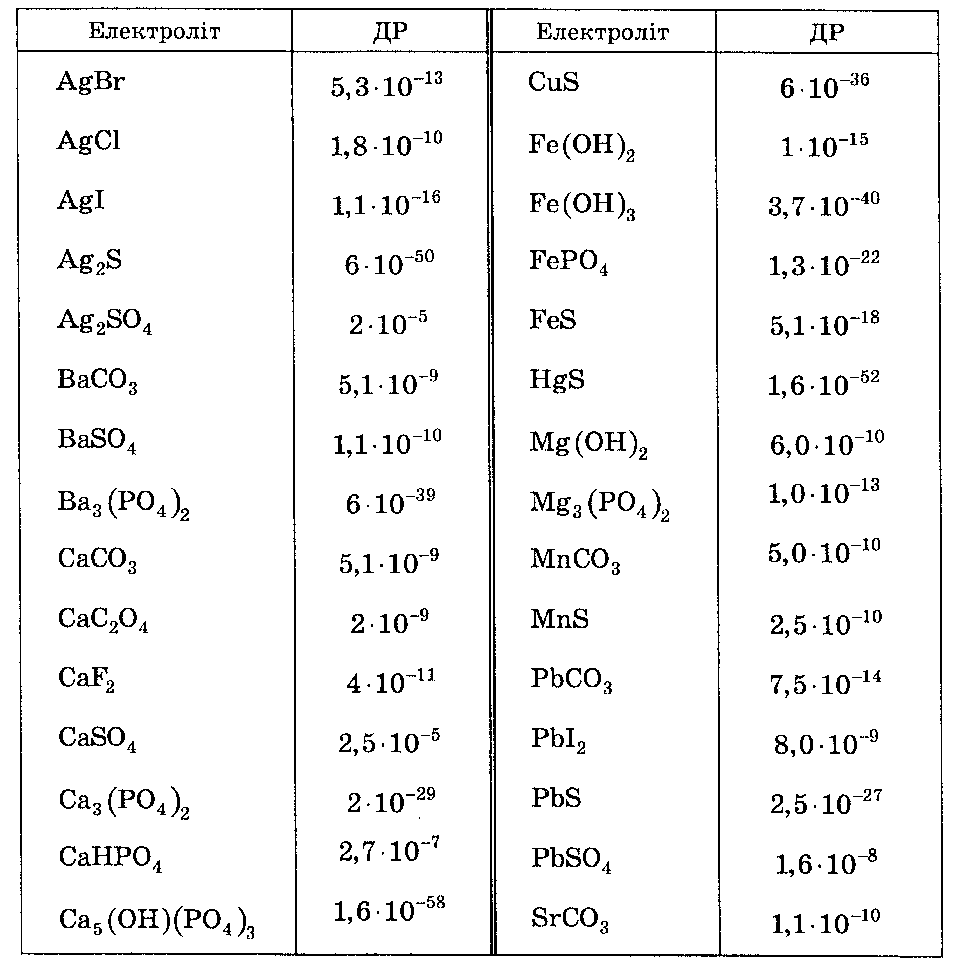
Для прикладу розрахуємо розчинність PbJ2 у дистильованій воді та у 0,001 М розчині Pb(NO3)2.
PbJ2 Pb2+ + 2J-
ДР (PbJ2) = [Pb2+] [J-]2
Для дистильованої води:
Нехай [Pb2+]= х моль/л. Тоді [J-]= 2х моль/л
Підсавляємо ці значення в вираз для добутку розчинності:
8,0 . 10-9 = х . (2х)2
8,0 . 10-9 = 4х3
Х3 = 2,0 . 10-9
Х= 6.1. 10-3 моль/л
Для 0,01 М розчину Pb(NO3)2.
[Pb2+]= 0,001 моль/л. Нехай [J-]= 2х моль/л
8,0 . 10-9 = 0,001 . (2х)2
Х2=2,0 . 10-6
Х= 1,4. 10-3 моль/л
Отже розчинність осаду зменшилась.
Для визначення розчинності малорозчинних сполук (моль/л) у дистильованій воді можна використовувати формули:

Існує правило, що при надлишку одного з йонів, що утворюють малорозчинну сполуку розчинність малорозчинної сполуки зменшується. Це при необхідності використовують для збільшення чутливості аналітичних реакцій. Але треба пам’ятати що при цьому не повинно відбуватись утворення комплексної сполуки.
Наприклад, якщо взяти надлишок калій йодиду, то розчинність gлюмбуv йодиду може не зменшитись, а навпаки збільшитись за рахунок утворення комплексної сполуки.
PbJ2 + 2 KJ = K2[PbJ4]
Аналізуючи вираз добутка розчинності можна також прийти до висновку, що якщо з розчину може утворюватись осади декількох різних малорозчинних речовин, то першим утворюється осад речовини для досягнення ДР якої потрібна менша концентрація осаджувача.
Наприклад, якщо в розчині є калій хлорид, калій бромід та калій йодид, то при додаванні аргентум нітрату спочатку утвориться осад аргентум йодиду, потім аргентум броміду і потім аргентум хлориду.
4. Способи вираження концентрацій в аналітичній хімії
Як правило в аналітичній хіміїї застосовують такі види концентрацій:
- нормальна (нормальність розчину) або еквівалентна концентрація,
- титр,
- титр за визначаємою речовиною.
Нормальна концентрація показує кількість моль-еквівалентів речовини в одному літрі розчину. Розраховується за формулою:
![]()
Cн. – нормальна концентрація розчину.
m – маса речовини в грамах.
ME – еквівалентна маса речовини.
V – об’єм розчину в літрах.
Для титрування в більшості випадків використовують 0,1 н. розчини. Їх готують використовуючи фіксанали (спеціальні ампули що використовують для приготування одного літра 0,1 н. розчину).

Всім нам також відома також молярна концентрація розчину яка показує кількість молей речовини в одному літрі розчину та розраховується за формулою:
![]()
Титр розчину показує кількість грамів речовини що міститься в 1 мл розчину. Розраховується за формулою:
![]()
Т – титр розчину
m – маса речовини в грамах.
V – об’єм розчину в мілілітрах.
Нормальна концентрація та титр пов’язані між собою:
![]() або
або
![]()
Титр за визначаємою речовиною показує кількість грамів речовини що відтитровується 1 мл розчину. Наприклад ми титруємо хлоридну кислоту розчином калій гідроксиду. Для титрування використовуємо розчин хлоридної кислоти такої концентрації: Т(HCl/KOH)=0,0042 г/мл. Це означає що один мілілітр цього розчину реагує з 0,0042 г калій гідроксиду. Такий способ вираження концентрації зручний для визначення маси речовини в зразкі для аналізу. Наприклад якщо на титрування зразка пішло 4 мл розчину хлоридної кислоти з концентрацією Т(HCl/KOH)=0,0042 г/мл, то в зразку для аналізу було 4.0,0042=0,0168 г калій гідроксиду.
