
- •Лекція 1: Предмет та основні поняття аналітичної хімії. Мета: Засвоїти предмет та основні поняття аналітичної хімії.
- •1. Основні поняття аналітичної хімії
- •2. Основні вимоги до аналітичних реакцій
- •3. Контрольні питання
- •1. Основні поняття аналітичної хімії
- •2. Основні вимоги до аналітичних реакцій
- •3. Контрольні питання
- •Лекція 2-3: Теоретичні основи аналітичної хімії. Мета: Засвоїти теоретичні основи аналітичної хімії.
- •1. Іонний добуток води та рН середовища
- •2. Буферні розчини
- •3. Розчинність малорозчинних сполук та добуток розчинності
- •4. Способи вираження концентрацій в аналітичній хімії
- •3. Контрольні питання
- •Лекція 4: Якісний аналіз.Кислотно-основна класифікація катіонів та аніонів Мета: Засвоїти кислотно-основну класифікація катіонів та аніонів
- •Кислотно-основна класифікація катіонів
- •2. Поділ аніонів на аналітичні групи
- •3. Основні визначення
- •Лекція 5: Кількісний аналіз. Гравіметричний метод аналізу. Мета: Засвоїти предмет та основні поняття аналітичної хімії.
- •1. Хімічні методи кількісного аналізу
- •2. Гравіметричний метод аналізу
- •Лекції 6-7: Титриметричний аналіз. Мета: Засвоїти основни титриметрії.
- •Мірні колби, мірні циліндри, піпетки.
- •Блок автоматичного титрування.
- •2. Метод нейтралізації
- •Титрування сильної кислоти лугом (або навпаки).
- •Титрування слабкої кислоти лугом.
- •Титрування слабкої основи сильною кислотою.
- •Титрування слабкої кислоти слабкою основою.
- •3. Метод оксидиметрії
- •4. Інші методи титриметрії
- •5. Контрольні питання
- •Лекція 8: Основні принципи та класифікація фізико-хімічних методів аналізу. Визначення густини. Мета: Засвоїти принципи та класифікацію фізико-хімічних методів аналізу.
- •1. Основні принципи фізико-хімічних методів аналізу
- •2. Класифікація фізико-хімічних методів аналізу.
- •3. Визначення густини.
- •Визначення густини за допомогою ареометра та ареометр з вмонтованим термометром.
- •Визначення температури плавлення та кипіння.
- •Лекція 9: Рефрактометрія, поляриметрія. Мета: Засвоїти основи рефрактометрії та поляриметрії.
- •Поляриметрія.
- •Лекція 10: Атомно-емісійний спектральний аналіз. Мета: Засвоїти принципи атомно-емісійного спектрального аналізу.
- •1. Основні принципи атомно-емісійного спектрального аналізу.
- •2. Принципова схема роботи полуменевого фотометра.
- •Лекція 11: Атомно-абсорбційний аналіз. Мета: Засвоїти принципи атомно-абсорбційного аналізу.
- •1. Основні принципи атомно-абсорбційного спектрального аналізу.
- •2. Принципова схема роботи атомно-абсорбційного спектрофотометра.
- •3. Практичне застосування методу.
- •Лекція 12: Фотометричний аналіз. Метод молекулярної абсорбції. Мета: Засвоїти основи фотометричного аналізу (метод молекулярної абсорбції).
- •Лекція 13: Фотометричний аналіз. Турбидиметрія, нефелометрія; люмінесцентний аналіз (флуориметрія). Мета: Засвоїти основи фотометричного аналізу (турбидиметрії, нефелометрії та флуориметрії).
- •Люмінесцентний аналіз
- •Флуориметри.
- •Явище люмінесценції
- •Лекція 14: Потенціометрія та потенціометричне титрування. Мета: Засвоїти основи потенціометрії.
- •Хлор срібний, скляний електроди та йонселективні електроди.
- •Лекція 15: Кондуктометрія та кондуктометричне титрування. Мета: Засвоїти основи кондуктомтрії.
- •Лекція 16: Електрогравіметрія та кулонометрія. Мета: Засвоїти основи електрогравіметрії та кулонометрії.
- •Лекція 17: Хроматографія та мас хроматографія. Мета: Засвоїти основи хроматографії.
- •Лекція 9: Рефрактометрія, поляриметрія. Мета: Засвоїти основи рефрактометрії та поляриметрії.
- •Поляриметрія.
- •Лекція 10: Атомно-емісійний спектральний аналіз. Мета: Засвоїти принципи атомно-емісійного спектрального аналізу.
- •1. Основні принципи атомно-емісійного спектрального аналізу.
- •2. Принципова схема роботи полуменевого фотометра.
- •Лекція 11: Атомно-абсорбційний аналіз. Мета: Засвоїти принципи атомно-абсорбційного аналізу.
- •1. Основні принципи атомно-абсорбційного спектрального аналізу.
- •2. Принципова схема роботи атомно-абсорбційного спектрофотометра.
- •3. Практичне застосування методу.
- •Лекція 12: Фотометричний аналіз. Метод молекулярної абсорбції. Мета: Засвоїти основи фотометричного аналізу (метод молекулярної абсорбції).
- •Лекція 13: Фотометричний аналіз. Турбидиметрія, нефелометрія; люмінесцентний аналіз (флуориметрія). Мета: Засвоїти основи фотометричного аналізу (турбидиметрії, нефелометрії та флуориметрії).
- •Люмінесцентний аналіз
- •Флуориметри.
- •Явище люмінесценції
- •Лекція 14: Потенціометрія та потенціометричне титрування. Мета: Засвоїти основи потенціометрії.
- •Хлор срібний, скляний електроди та йонселективні електроди.
- •Лекція 15: Кондуктометрія та кондуктометричне титрування. Мета: Засвоїти основи кондуктомтрії.
- •Лекція 16: Електрогравіметрія та кулонометрія. Мета: Засвоїти основи електрогравіметрії та кулонометрії.
- •Лекція 17: Хроматографія та мас хроматографія. Мета: Засвоїти основи хроматографії.
2. Класифікація фізико-хімічних методів аналізу.
Визначення густини, температури плавлення, кипіння.
Рефрактометрія
Поляриметрія
Оптичні методи аналізу:
Атомно-емісійний спектральний аналіз
Атомно-абсорбційний аналіз
Фотометричний аналіз
Метод молекулярної абсорбції
Турбидиметрія
Нефелометрія
Люмінесцентний аналіз, флуориметрія.
Електрохімічні методи аналізу
Потенціометрія та потенціометричне титрування
Кондуктометрія та кондуктометричне титрування
Полярографія та амперметрія
Електрогравіметрія та кулонометрія
Хроматографія та мас-хроматографія
3. Визначення густини.
Густина () – це маса речовини в одиниці об’єму.
![]()
Одиниці вимірювання г/мл або кг/м3.
Густина розчинів є функцією від концентрації тому вимірювання густини широко використовується для визначення концентрації розчинів. Для багатьох речовин існують таблиці залежності густини від концентрації розчинів.
Якщо таблиць не має то попередньо будують калібрувальний графік залежності густини від концентрації розчинів (в координатах густина розчину в залежності від концентрації) використовуючи серію розчинів з відомими концентраціями.
Визначають за допомогою ареометрів.

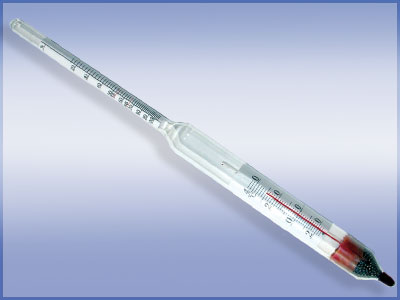
Визначення густини за допомогою ареометра та ареометр з вмонтованим термометром.
Як правило використовують цілий набір ареометрів на різні діапазони густин. Правильно підібраний ареометр повинен плавати в рідині.
Густина залежить від температури. Тому необхідно зазначати для якої температури визначається густина, а при необхідності стабілізувати температуру. Існують ареометри в які одночасно вмонтований термометр.
Для деяких речовин існують спеціалізовані ареометри проградуйовані не в одиницях густини, а відразу в одиницях концентрації (для спирту, цукру…).
Визначення температури плавлення та кипіння.
Температура плавлення та кипіння для кожної речовини є константами. Тому інколи для перевірки тої чи іншої речовини вимірюють температуру її плавлення та кипіння.
Чиста речовина завжди має сталу температуру кипіння. Речовина з домішками як правило плавиться при нижчій температурі та в певному інтервалі температур.

Напівавтоматичний прилад для визначення температури плавлення.
4. Контрольні питання
Що таке калібрувальний графік?
Що таке інструментальне титрування.
Що таке метод добавок?
Що таке ареометр?
В яких одиницях вимірюється густина розчинів?
Лекція 9: Рефрактометрія, поляриметрія. Мета: Засвоїти основи рефрактометрії та поляриметрії.
План:
Рефрактометрія
Поляриметрія.
Рефрактометрія
Рефрактометрія
– це визначення показника заломлення.
Показник заломлення (n)
є однією з констант, що добре характеризують
індивідуальність та ступінь чистоти
органічної сполуки.
![]()
Визначається
спеціальним приладом – рефрактометром,
який працює на принципі вимірювання
граничного кута заломлення. Якщо кут
падіння 90° (саме цей кут використовується
в рефрактометрах), то промінь світла
утворює граничний кут заломлення. При
цьому
![]()
Вимірюючи і знаючи n1 можна визначити n2 Граничний кут визначають по границі світла й тіні що спостерігається в рефрактометрах. Середовищами є скло (скляні призми) з відомим показником заломлення та середовище показник заломлення якого визначаємо.

Показник
заломлення
![]() залежить
від:
залежить
від:
Природи речовини
Густини
Концентрації розчину
Температури
Тиску
Довжини хвилі.
Перед
початком вимірювань прилад перевіряють
по дистильованій воді.
![]()
Індекс D означає що використовують жовту лінію в спектрі натрієвої лампи.
Верхній індекс показує температуру при якій визначають показник заломлення.
Для ідентифікації речовини показник заломлення можна визначити з точністю 3 знаки після коми, для перевірки чистоти 4 знаки після коми.
Як правило будують калібрувальний графік залежності показника заломлення від концентрації розчину по розчинах з відомою концентрацією.

Далі визначивши показник заломлення невідомого розчину визначають його концентрацію.
Інколи використовують рефрактометричний фактор F, який показує збільшення показника заломлення розчину при зростанні його концентрації на 1%.
![]()
Знаючи показник заломлення розчину та розчинника можна визначити його концентрацію.
