
- •Общие сведения.
- •Физические свойства:
- •Химическе свойства:
- •Получение.
- •Качественный анализ.
- •Аналитические реакции на катион железа (III).
- •Аналитические реакции на хлорид-ион.
- •Количественный анализ.
- •Фотоколориметрия. Фотоколориметрическое определение железа(III)
- •Методика Приготовление стандартного раствора
- •Приготовление эталонных растворов
- •Измерение оптических плотностей эталонных растворов
- •Построение градуировочного графика
- •Определение концентрации железа в растворе
- •Приготовление эталонных растворов
- •Измерение оптических плотностей эталонных растворов
- •Построение градуировочного графика
- •Определение содержания железа (III) в растворе
- •Применение.
- •Список литературы.
Аналитические реакции на хлорид-ион.
С групповым реагентом – раствором AgNO3:
Методика: К 2 каплям раствора, содержащего хлорид-ионы, прибавляют 1 каплю разбавленной HNO3 и 3 капли раствора AgNO3. Наблюдаемый белый творожистый осадок растворим в NH4OH и насыщенном растворе (NH4)2CO3.
Раствор [Ag(NH3)2]Cl делят на 2 части: к одной добавляют концентрированную HNO3 до кислой реакции среды, к другой – концентрированный раствор KJ. Наблюдают выпадение осадков или помутнение раствора:
[Ag(NH3)2]Cl + 2HNO3 ↔ AgCl↓ + 2 NH4NO3
[Ag(NH3)2]Cl + KJ + 2H2O ↔ AgJ↓ + KCl + 2NH4OH
Количественный анализ.
Фотоколориметрия. Фотоколориметрическое определение железа(III)
Определение
железа(III)
основано на измерении количества
поглощённого полихроматического
излучения окрашенным комплексным
соединением железа(III)
с тиоцианатом аммония (определение по
фотометрической реакции), lтах
= 540 нм,
![]() = 482,20 г/моль,
= 482,20 г/моль,
![]() = 55,85 г/моль.
= 55,85 г/моль.
Ион железа(III) в зависимости от концентрации тиоцианат-ионов образует ряд комплексных ионов кроваво-красного цвета
Fe3+ + nSCN- ® [Fe(SCN)n3-n];
где n - число связанных тиоцианат-ионов, n = 1 – 6 .
Методика Приготовление стандартного раствора
0,0864
г (точная навеска) «хч» NH4Fe(SO4)2
´12H2O
помещают в мерную колбу вместимостью
100 см3,
растворяют в дистиллированной воде,
подкисляют 15 см3
2 моль/дм3
раствора азотной кислоты, доводят водой
до метки, перемешивают (![]() =
0,1 мг/см3).
=
0,1 мг/см3).
Приготовление эталонных растворов
В шесть мерных колб вместимостью 100 см3 последовательно вносят из бюретки 2, 4, 6, 8, 10 и 0 см3 приготовленного стандартного раствора, прибавляют 5 см3 20%-ного раствора тиоцианата аммония, доводят объём дистиллированной водой до метки, перемешивают.
Примечание: желательно готовить не всю серию растворов сразу, а по одному раствору и сразу его фотометрировать, поскольку растворы тиоцианата железа(III) при стоянии медленно обесцвечиваются, вследствие восстановления железа(III) тиоцианат-ионами.
Измерение оптических плотностей эталонных растворов
Измеряют оптическую плотность приготовленных эталонных растворов в кювете толщиной 2 см при аналитической длине волны 540 нм относительно эталонного раствора № 6, проводят два параллельных измерения и заносят результаты в таблицу. Рассчитывают молярный коэффициент поглощения для каждого эталонного раствора ei. Из пяти рассчитанных значений молярных коэффициентов поглощения находят среднее значение eCР.
Построение градуировочного графика
По полученным данным строят градуировочный график, откладывая на оси абсцисс титр растворов (Т, мг/см3), а на оси ординат – оптическую плотность А.
Определение концентрации железа в растворе
Точный объём раствора (индивидуальное задание) помещают в мерную колбу вместимостью 100 см3, прибавляют 15 см3 2 моль/дм3 раствора азотной кислоты, 5 см3 20%-ного раствора тиоцианата аммония, доводят объём водой до метки, перемешивают. Измеряют оптическую плотность полученного раствора.
По градуировочному графику находят концентрацию (Т, мг/см3) анализируемого раствора и рассчитывают содержание (мг) железа(III)в общем объёме анализируемого раствора
![]() .
.
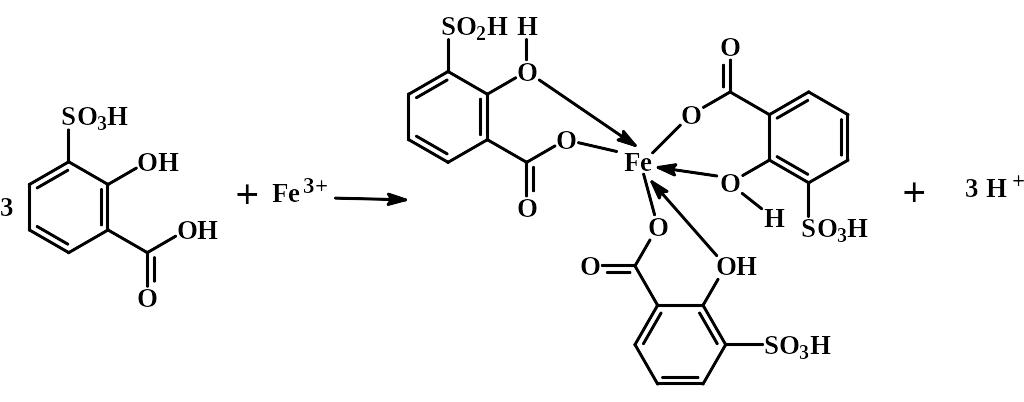
ДИФФЕРЕНЦИАЛЬНОЕ ФОТОКОЛОРИМЕТРИЧЕСКОЕ
ОПРЕДЕЛЕНИЕ ЖЕЛЕЗА(III) В ВИДЕ ТРИСУЛЬФОСАЛИЦИЛАТА ЖЕЛЕЗА
Метод основан на измерении количества поглощённого полихроматического излучения окрашенным комплексным соединением железа (III) с сульфосалициловой кислотой в щелочной среде, раствор сравнения – раствор трисульфосалицилата железа(III) известной концентрации, КH = 3,94´10-34, l = 416 нм, e = 5800 моль-1´ дм3 ´ см-1(определение по фотометрической реакции).
МЕТОДИКА
Приготовление стандартного раствора
Массу навески сульфата аммония-железа (железоаммониевых квасцов), необходимую для приготовления стандартного раствора железа(III) с титром 1,0000 мг/ см3, вычисляют по формуле:
![]()
где: М - молярная масса NH4Fe(SO4)2 ´ 12H2O = 482,19 г/моль;
М* - молярная масса Fe = 55,85 г/моль.
Навеску сульфата аммония-железа, взятую на аналитических весах, количественно переносят в мерную колбу вместимостью 100 см3, растворяют при нагревании в небольшом количестве дистиллированной воды с добавлением 1 см3 концентрированной серной кислоты, после охлаждения объём раствора доводят водой до метки, перемешивают.
