
- •Прикладна електрохімія Методичні вказівки до виконання лабораторних робіт
- •Лабораторна робота 1. Хімічне нікелювання поверхні діелектриків
- •Лабораторна робота 2. Вилучення іонів нікелю з відпрацьованого розчину хімічного нікелювання
- •Лабораторна робота 3. Електрохімічне осадження міді
- •Лабораторна робота 4. Електрохімічне вилучення міді
- •Методика виконання роботи
- •Лабораторна робота 5. Електрохімічне осадження нікелю.
- •Лабораторна робота 6. Електрохімічне анодування алюмінію
- •Лабораторна робота 7. Електрохімічне цинкування.
- •Лабораторна робота 8. Дослідження деяких параметрів вторинних хімічних джерел струму
Лабораторна робота 3. Електрохімічне осадження міді
Мета роботи – ознайомитись з процесом електроосадження міді і формування мідних покрить.
Завдання роботи – осадити мідне покриття на поверхню металу, визначити вплив густини струму на якість покрить; вплив кислотності на якість мідних покрить. Знайти залежність виходу за струмом від густини струму та оцінити пористість мідного осаду.
Короткий огляд теоретичних основ процесу
Мідні покриття формують на поверхні інших металів для забезпечення кращого зовнішнього вигляду (імітація мідних виробів на поверхні сплавів чорних металів), для підтримки кращої електропровідності (міднення контактів) та для інших потреб. Окрім чисто мідних покрить часто формують осади з мідних сплавів (здебільшого різних видів латуні), які мають кращу механічну стійкість та більш корозійно стійкі. Однак мідні та латунні осади не забезпечують тривалого захисту від корозії оскільки сама мідь кородує і вкривається пухким шаром основних карбонатних солей зеленого кольору. Крім того, пористе мідне покриття не забезпечує повної ізоляції поверхні підложки від дії кисню і води, тому остання повільно кородую під мідним покриттям. Утворення продуктів корозії деформує покриття і спричиняє його відшаровування.
Мідні осади також створюють в якості основи для подальшого осадження на них інших металів (хрому, нікелю), які краще зчіплюються саме з міддю, а не з чорними металами.
Мідь осаджують або з простих
електролітів на основі солі
![]() (часто з додаванням сульфатної кислоти),
або з комплексних електролітів, де мідь
частіше знаходиться у вигляді ціанідних
комплексів
(часто з додаванням сульфатної кислоти),
або з комплексних електролітів, де мідь
частіше знаходиться у вигляді ціанідних
комплексів
![]() (
(![]() ,
n = 2-4), або пірофосфатних
комплексів
(
,
n = 2-4), або пірофосфатних
комплексів
(![]() .
.
Невеликі кількості сульфатної кислоти позитивно впливають на якість покриття і на ефективність процесу осадження. Крім того, у присутності кислоти пригнічується проходження небажаного процесу нагромадження сполук Cu(I) у системі.
У простому кислому електроліті основна реакція на катоді така:
![]() .
.
Побічна реакція – неповне розряджання міді з утворенням іонів :
![]()
В якості аноду використовують мідні болванки, які розчиняються з утворенням іонів міді.
У свіжому правильно приготованому електроліті вихід по струму майже 100 %, побічні процеси малопомітні. Розсіююча здатність цього електроліту середня, що не дозволяє отримувати якісні покриття на деталях складної форми. Перенапруга виділення міді низька, що зумовлює утворення грубокристалічних покрить.
В ході роботи в електроліті можуть накопичуватись іони одновалентної міді. При достатній кислотності вони хімічно окиснюються киснем:
![]()
При низькій кислотності, або
у достатньо старих електролітах іони
гідролізуються з утворенням оксиду
![]() :
:
![]() .
.
Частинки цього оксиду
захоплюються мідним осадом погіршуючи
його механічні якості та структуру. У
присутності різноманітних органічних
ПАР формуються блискучі покриття.
Кращому блиску та розсіювальній здатності
сприяє також додавання до електроліту
![]() .
.
Мідні покриття з ціанідних лужних електролітів осідають дрібнозернистими, їх якість набагато вища, ніж у покрить з простих електролітів. Це пояснюється надзвичайною стійкістю ціанідних комплексів міді(І) (їх константи нестійкості оцінюються інтервалом 10-24 – 10-31). Внаслідок цього на катоді створюється значна перенапруга виділення міді. З іншого боку, перенапруга виділення водню на міді теж висока (це перешкоджає утворенню бульбашок газу), що разом і зумовлює високу якість осадів.
Розсіювальна здатність ціанідних електролітів теж вища, ніж у простих, а вихід по струму незначно поступається останнім.
Особливістю ціанідних електролітів є те, що їх готують тільки виходячи зі сполук . Окиснювальний потенціал йону достатній для того, щоб окиснити ціанід-йон за схемою:
![]() .
.
При цьому виділяється високотоксичний леткий диціан, а частина ціаніду непродуктивно окиснюється і втрачається. Для запобігання цьому (в ході електролізу можливе формування йонів ) до електроліту додають сильний відновник (натрій сульфіт), який переводить шкідливі йони назад у одновалентну мідь.
Аноди виготовляють з чистих
мідних болванок, однак в ході роботи по
мірі зниження концентрації ціанід йонів
у електроліті, вони (саме аноди) пасивуються
за рахунок утворення поверхневої плівки
![]() .
.
Також до ціанідних електролітів
додають блискоутворюючі добавки ПАР і
натрій (калій) карбонат (для підвищення
електропровідності та для підтримки
лужного середовища – у кислому ціаніди
гідролізуються утворюючи токсичну й
летку
![]() ).
).
Якість «ціанідних» покрить найвища, технологія недорога та екологічно безпечна (при дотриманні режиму роботи). Разом з тим, наслідки можливих аварійних скидів достатньо важкі, а робота працівників у ціанідних цехах надто шкідлива.
Через це, ціанідні технології
сьогодні заміняють на менш токсичні
(хоча й не такі ефективні). Одним з
найбільш вдалих рішень стало використання
пірофосфатних комплексних електролітів.
Вихід по струму і якість зчеплення
покриття з основою тут нижча, ніж у
ціанідних аналогів, однак пірофосфат
йони
![]() досить активно адсорбуються на поверхні
катоду, виконуючи роль своєрідної ПАР
та забезпечуючи достатньо високу
перенапругу і дрібнозернисту структуру
мідного осаду. Токсичність пірофосфатів
значно нижча, ніж у ціанідів, хоча
довгострокова екологічна шкідливість
– вища (ціаніди швидко окиснюються у
довкіллі до нетоксичних карбонатів, а
пірофосфати досить стійкі). Пірофосфатні
електроліти працюють у слаблужному
середовищі також з мідними анодами, які
з часом пасивуються, вкриваючись складною
гідроксо-сольовою плівкою з фофатів і
різних полі фосфатів міді.
досить активно адсорбуються на поверхні
катоду, виконуючи роль своєрідної ПАР
та забезпечуючи достатньо високу
перенапругу і дрібнозернисту структуру
мідного осаду. Токсичність пірофосфатів
значно нижча, ніж у ціанідів, хоча
довгострокова екологічна шкідливість
– вища (ціаніди швидко окиснюються у
довкіллі до нетоксичних карбонатів, а
пірофосфати досить стійкі). Пірофосфатні
електроліти працюють у слаблужному
середовищі також з мідними анодами, які
з часом пасивуються, вкриваючись складною
гідроксо-сольовою плівкою з фофатів і
різних полі фосфатів міді.
МЕТОДИКА ВИКОНАННЯ РОБОТИ
Підготувати 5 мідних і 1 сталевий катод. Спочатку їх слід відшліфувати наждачним папером для видалення оксидних та сольових нашарувань. Потім катоди знежирити у лужному розчині (5-15 г/л NaOH, 15-35 г/л Na3PO4 . 12H2O, 15-35 г/л Na2CO3, 3-5 г ПАР (Синтанол ДС-10, або інший)) при 60-80 0С протягом 5-10 хв.
Промити електроди у дистильованій воді і активувати шляхом занурення у розчин H2SO4 (50 г/л) при кімнатній температурі на 0,5-1 хв.
Електроди промити, висушити та зважити. Всі результати зважувань занести у протокол.
З
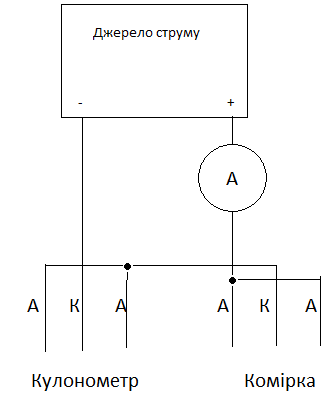 ібрати
електричну схему для електроосадження
міді (Рис. 1).
ібрати
електричну схему для електроосадження
міді (Рис. 1).
Рис. 1. Схема електричних з’єднань для осадження міді
Зібрати кулонометр і комірку, заливши у останню простий електроліт міднення без кислоти (вміст CuSO4 . 5H2O 250 г/л).
Визначити тривалість міднення для вказаних викладачем товщин покрить, використовуючи дані з Таблиці 1.
Таблиця 1
Тривалість міднення (хв) за умови 100 % виходу за струмом для різних густин струму (і, А/дм2) і товщин осаду (h, мкм).
|
i |
|||||
h |
1 |
2 |
4 |
6 |
8 |
10 |
3 |
13.5 |
6.8 |
3.4 |
2.2 |
1.7 |
1.3 |
5 |
22.5 |
11.2 |
5.6 |
3.7 |
2.8 |
2.2 |
10 |
45.0 |
22.5 |
11.3 |
7.5 |
5.6 |
4.5 |
Виміряти розміри катоду і розрахувати його площу (з двох сторін), обчислити силу струму, який необхідно пропускати для забезпечення вказаної густини струму на даному катоді.
Послідовно провести електроліз із 5 катодами та різними густинами струму. Перед початком електролізу кожен катод зважити, записавши у протокол його вагу перед електролізом (m1). Також перед початком кожного електролізу слід зважити промитий і висушений катод кулонометру. Цю масу теж занести у протокол (m1к).
Після закінчення електролізу катод слід висушити і знов зважити, записавши у протокол його масу після електролізу (m2). Промити і висушити катод кулонометру, зважити його і записати масу катоду після електролізу (m2к).
Візуально оцінити всі 5 покрить і зробити висновок про вплив густини струму на якість мідного покриття у простому електроліті.
Повторити операції 6-11 для ще одного мідного катоду, який піддається електролізу у простому кислотному електроліті (вміст CuSO4 . 5H2O 250 г/л; сульфатної кислоти – 50 г/л) з тією ж густиною струму, для якої отримане найбільш якісне покриття у простому електроліті без кислоти. Порівняти аналогічні покриття для електролітів з кислотою і без та зробити висновок про вплив сульфатної кислоти на якість мідного покриття.
Для всіх зразків розраховують вихід за струмом. Результати розрахунків для перших п’яти зразків подають у графічній формі як залежність виходу за струмом від густини струму.
Для визначення пористості мідного покриття використовується електроліт складу CuSO4 . 5H2O – 90 г/л, K4P2O7 . 3H2O – 370 г/л і сталевий зразок. Його піддають електролізу протягом часу, необхідного для утворення покриття товщиною 3 мкм при густині струму, необхідній для отримання найбільш якісного покриття.
Після закінчення електролізу катод слід обережно промити, не висушувати і не зважувати, а обернути у фільтрувальний папір, змочений розчином K3[Fe(CN)6] (10 г/л) і NaCl (20 г/л). Залишити зразок обернутим на 10 хв.
Обережно зняти фільтрувальний папір і залишити його для висихання до наступного дня.
Після висихання окреслити на довільній ділянці паперу, що контактувала з електродом, квадрат 1 см2 і підрахувати кількість синіх крапок, що вказують на суцільні пори у міді до сталевої основи. Результат підрахунку занести у підсумкову таблицю.
У підсумковому протоколі (з використанням Таблиці 2) на базі отриманих даних слід зробити висновки про: а) вплив густини струму на якість осаду; б) вплив присутності кислоти на якість осаду; в) залежність виходу за струмом від густини струму і наявності кислоти; г) пористість отриманого мідного покриття на сталі.
Таблиця 2
Таблиця для занесення результатів вимірювань і розрахунків.
№ зразка |
Електроліт |
Площа (S), дм2 |
Густина струму (i), A/дм2 |
Сила струму, А |
Якість (пористість) покриття |
(комірка) |
(кулонометр) |
|
1 мідний |
Простий |
|
|
|
|
|
|
|
2 мідний |
Простий |
|
|
|
|
|
|
|
3 мідний |
Простий |
|
|
|
|
|
|
|
4 мідний |
Простий |
|
|
|
|
|
|
|
5 мідний |
Простий |
|
|
|
|
|
|
|
6 мідний |
Кислий |
|
|
|
|
|
|
|
7 сталевий |
Пірофосфат |
|
|
|
|
|
|
|
ВИСНОВКИ ПО РОБОТІ
а) Вплив густини струму на якість осаду:
б) Вплив присутності кислоти на якість осаду:
в )
Залежність виходу за струмом від густини
струму (графік можна подати на окремому
аркуші) і наявності кислоти:
)
Залежність виходу за струмом від густини
струму (графік можна подати на окремому
аркуші) і наявності кислоти:
ВС

і
г) Пористість отриманого мідного покриття на сталі:
ОРІЄНТОВНИЙ ПЕРЕЛІК ПИТАНЬ ДЛЯ ЗДАЧІ РОБОТИ
Основи, електрохімічні особливості різних методів міднення.
Сфера застосування, мета, переваги й недоліки електрохімічного міднення.
Роль кожного компоненту електроліту та суть окремих стадій процесу міднення.
Технологія електрохімічного міднення.
Вплив процесів електрохімічного міднення на довкілля, можливість його зменшення.
