
- •Прикладна електрохімія Методичні вказівки до виконання лабораторних робіт
- •Лабораторна робота 1. Хімічне нікелювання поверхні діелектриків
- •Лабораторна робота 2. Вилучення іонів нікелю з відпрацьованого розчину хімічного нікелювання
- •Лабораторна робота 3. Електрохімічне осадження міді
- •Лабораторна робота 4. Електрохімічне вилучення міді
- •Методика виконання роботи
- •Лабораторна робота 5. Електрохімічне осадження нікелю.
- •Лабораторна робота 6. Електрохімічне анодування алюмінію
- •Лабораторна робота 7. Електрохімічне цинкування.
- •Лабораторна робота 8. Дослідження деяких параметрів вторинних хімічних джерел струму
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ЧЕРНІВЕЦЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ
ІМЕНІ ЮРІЯ ФЕДЬКОВИЧА
І. А. Вінклер, В. Р. Водянка, Я. Ю. Тевтуль
Прикладна електрохімія Методичні вказівки до виконання лабораторних робіт
Чернівці
Чернівецький національний університет
2013
УДК ХХХХХХ
ББК ХХХХХ
ХХХХХХХ
Друкується за ухвалою редакційно-видавничої ради
Чернівецького національного університету
імені Юрія Федьковича
ХХХХ Вінклер І. А. Прикладна електрохімія : методичні вказівки до виконання лабораторних робіт / І. А. Вінклер, В. Р. Водянка, Я. Ю. Тевтуль. – Чернівці : ЧНУ, 2013. – 36 с.
Описано виконання лабораторних робіт, а також наведені короткі теоретичні відомості до кожної лабораторної роботи, викладена послідовність дій і операцій, що належить опанувати студентам.
Для студентів хімічних і хіміко-технологічних спеціальностей ВНЗ.
ХХХХХХХ
ХХХХХХХХХ
© “Чернівецький національний університет”, 2013
ЗМІСТ
Лабораторна робота 1. Хімічне нікелювання поверхні діелектриків 4
Лабораторна робота 2. Вилучення іонів нікелю з відпрацьованого розчину хімічного нікелювання 9
Лабораторна робота 3. Електрохімічне осадження міді 16
Лабораторна робота 4. Електрохімічне вилучення міді 25
Лабораторна робота 5. Електрохімічне осадження нікелю. 30
Лабораторна робота 6. Електрохімічне анодування алюмінію 37
Лабораторна робота 7. Електрохімічне цинкування. 43
Лабораторна робота 8. Дослідження деяких параметрів вторинних хімічних джерел струму 49
Лабораторна робота 1. Хімічне нікелювання поверхні діелектриків
Мета роботи – ознайомитись з технологією отримання металевих покрить на діелектриках.
Завдання роботи – отримати металеве покриття на поверхні пластмаси, визначити якість та міцність покриття.
Короткий огляд теоретичних основ процесу
Хімічне нікелювання поверхні діелектриків застосовують для створення металевого покриття на поверхні матеріалів (здебільшого різних пластмас), які не проводять електричний струм і не можуть бути покриті металом традиційними електрохімічними методами. Металеве покриття може бути необхідне для забезпечення кращого зовнішнього вигляду виробу (імітування металу на пластмасових деталях), більшої поверхневої міцності деталей, в разі необхідності надання деталі електропровідності (адитивний метод виробництва друкованих плат), для забезпечення світловідбивання та ін.
Хімічно осаджений шар нікелю достатньо твердий, корозійно та механічно стійкий. У процесі хімічного нікелювання утворюється не чистий нікель, а його сплав з фосфором (7÷15 %), але для більшості застосувань, наявність таких кількостей фосфору у металевому шарі не шкідлива.
Процес хімічного нікелювання – це хімічне автокаталітичне відновлення йонів нікелю з розчину за допомогою натрій гіпофосфіту. Застосування саме цього відновника пояснюється тим, що за певних умов він забезпечує процес відновлення тільки на попередньо активованій поверхні діелектрика. Завдяки цьому на ній формується щільний металевий шар, а робочі поверхні ємності для нікелювання залишаються чистими. Автокаталітичний характер процесу відновлення також сприяє тому, що майже весь нікель осідає на попередньо активованому діелектрику, а не на інших поверхнях. Нікель витрачається переважно на формування корисного металевого покриття, а швидкість процесу достатньо велика для створення ефективних промислових технологій хімічного нікелювання.
Окрім хімічного нікелювання за допомогою натрій гіпофосфіту існують також технології формування покрить з нікелю, міді та паладію, де відновниками використовують гідразин, формальдегід, фосфіт, натрій тіосульфат та іони-відновники деяких металів. Далі ми розглядатимемо гіпофосфітний процес хімічного нікелювання.
Найкращі умови для хімічного нікелювання – температура біля 80 0С і слабокисле середовище.
Хімічні процеси нікелювання описують так.
У слабоксилому розчині на поверхні металу гіпофосфіт-йон здатен реагувати з гідроксид-йоном. При цьому один з гідрогенів, безпосередньо зв’язаних з фосфором заміщується на гідроксидну групу, надлишковий електрон переходить на поверхню металу, а атоми гідрогену потім утворюють молекулу водню. Надлишкові електрони витрачаються на відновлення іонів Гідрогену:
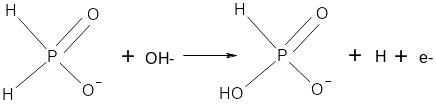
(1)
![]() (2)
(2)
Крім того, надлишкові електрони, що утворюються у реакції (1) відновлюють йони нікелю. Ця реакція відбувається на поверхні активованого діелектрика:
![]() (3)
(3)
Разом з описаними процесами на поверхні металу відбувається також відновлення гіпофосфіт-іонів до фосфору:
![]() . (4)
. (4)
Просумувавши рівняння (1) і (3) можна записати сумарне рівняння взаємодії іонів гіпофосфіта й нікелю:
![]() (5).
(5).
З останнього рівняння видно, що процес мав би проходити ефективніше у лужному середовищі, однак у ньому йони нікелю утворюють нерозчинний гідроксид. З іншого боку, у сильно кислому середовищі концентрація гідроксид-йонів буде надто низькою для забезпечення проходження реакції (1). Тому оптимальним є проведення процесу у слабо кислому середовищі, де концентрація гідроксид-йонів ще достатня для реакції (1), але осад гідроксиду нікелю не утворюється.
Автокаталітичний механізм забезпечується у процесі за рахунок того, що збільшується кількість центрів, на яких відбувається відновлення іонів нікелю (рівняння реакції 3).
Зростаючий шар металевого нікелю розширює поверхню деталі, на якій відбувається реакція і прискорює процес виділення нікелю.
Під час нікелювання недопустима присутність частинок металевого нікелю у розчині, оскільки на них теж буде відбуватися реакція осадження металу. Після видалення металізованого пластмасового виробу відновлення іонів нікелю на частинках металу продовжуватиметься і швидко зіпсує розчин нікелювання. Ці небажані процеси зменшують швидкість та ефективність нікелювання. Для уникнення цього у розчини промислового хімічного нікелювання додають активні комплексони, які «зв’язують» мікроскопічні частинки металевого нікелю, що можуть відірватись від материнської поверхні.
У технології хімічного нікелювання застосовують активатор. Його роль полягає у створенні мікроскопічних металевих зародків, на яких розпочинається відновлення іонів нікелю й утворення металевого покриття.
Для активування поверхні пластмаси її попередньо травлять, промивають, а потім занурюють у розчин-сенсибілізатор.
Для сенсибілізації протравлену пластмасу занурюють у розчин солі Стануму(ІІ).
На місцях утворення дефектів на свіжопротравленої поверхні сіль частково гідролізується і утворює гідроксосіль:
![]() .
.
Наступне внесення сенсибілізованої поверхні у розчин солі благородного металу (йони благородних металів – дуже сильні окисники) спричиняє окиснення йонів стануму і осадження благородного металу на сенсибілізованій поверхні.
![]() .
.
Таким чином на поверхні діелектрику формуються мікроскопічні металічні острівці, з яких починається процес металізації. Оскільки острівці сформовані благородним металом, вони не піддаються подальшим хімічним перетворенням, а метал лишається здатним до перенесення електронів для забезпечення металізації. Незважаючи на це, для ефективного проходження процесу варто скоротити час між сенсибілізацією, активацією і власне металізацією до мінімуму.
Варто відмітити, що незважаючи на відсутність зовнішнього електроструму, даний процес хімічного нікелювання може розглядатись як електрохімічний, оскільки у ньому існує окремий анодний процес (1), у якому формуються вільні електрони, які потім переносяться в зону проходження катодних процесів (3) і (4).
МЕТОДИКА ВИКОНАННЯ РОБОТИ
Знежирити зразок пластмаси зануривши його на 10 хв у розчин Натрій карбонату (10 г/л, 60-70 0С), або Натрій фосфату (20 г/л, 30-40 0С).
Промити зразок гарячою водою, а потім ретельно промити його дистильованою водою.
Протравити зразки, зануривши їх у хромову суміш (350-380 г/л хромового ангідриду та 400 г/л сульфатної кислоти) на 10 хв при температурі 60-70 0С. Обережно! Хромова суміш дуже агресивна, токсична і небезпечна – уникайте її потрапляння на шкіру та в очі!
Промити зразок дистильованою водою.
Сенсибілізувати поверхню зразку у розчині Станум(ІІ) хлориду при температурі 30-40 0С шляхом занурення зразка у розчин на 10 хв.
Витягнути зразок з розчину сенсибілізації і не промиваючи його занурити у дистильовану воду на 5 хв (температура 30-40 0С) для гідролізу солі Стануму.
Перенести зразок у розчин для активації (1 г/л Паладій хлориду і 40-60 г/л хлоридної кислоти) на 2-3 хв (кімнатна температура).
Промити зразок дистильованою водою.
Визначити концентрацію іонів нікелю у розчині за допомогою титрування його стандартним розчином трилону Б з аміачним буфером по індикатору мурексиду до зміни забарвлення на фіолетове.
Нікелювання проводити приблизно 30 хв обережно перемішуючи розчин і спостерігаючи за тим, щоб виділення водню відбувалось не дуже бурхливо. В разі надлишкового газовиділення розчин трохи охолодити.
Після закінчення нікелювання зразок винути з розчину, промити проточною водою і висушити. Для перевірки міцності зчеплення металу з пластмасою слід зробити скальпелем декілька перпендикулярних надрізів на металевій поверхні на відстані ~ 4 мм один від одного. Наявність і ступінь відшарування металу від основи дозволяє зробити висновок про якість зчеплення покриття.
Склад базового розчину для нікелювання: (варіант 1) NiSO4 25-30 г/л; NaH2PO2 40-45 г/л; NH4Cl 22-29 г/л; PbCl2 0,007-0,01 г/л; (варіант 2) NiCl2 25 г/л; NaH2PO2 25 г/л; NH4Cl 25 г/л; уротропін 0,3-0,5 г/л
Для здачі роботи пред’являється металізований зразок і протокол виконання роботи з усіма проведеними вимірюваннями, розрахунками і висновками про якість і міцність металевого покриття.
ОРІЄНТОВНИЙ ПЕРЕЛІК ПИТАНЬ ДЛЯ ЗДАЧІ РОБОТИ
Основи методу хімічної металізації діелектриків.
Обґрунтувати електрохімічний механізм процесів хімічного нікелювання.
Сфера застосування, мета, переваги й недоліки хімічної металізації поверхонь.
Роль кожного реагенту і суть окремих стадій процесу хімічної металізації.
Реалізації технологій металізації діелектриків, різновиди цих технологій, приклади металізованих діелектричних виробів.
Вплив технологій хімічної металізації на довкілля, можливість зменшення негативної дії на організми.
