
- •Лекция № 3 Тема:
- •Резистентность и восприимчивость макроорганизма
- •Классификация инфекционных болезней
- •Понятие об эпидемическом процессе и его формах
- •Иммунитет (основы иммунологии)
- •Конституциональные факторы естественной резистентности
- •Антигены
- •Иммунная система
- •Строение и биологическая роль органов иммунитета
- •Антитела (иммуноглобулины)
- •Антителообразование
- •Иммунный ответ
- •Цитокины
- •Спектр действия интерлейкинов
- •Теории антителообразования и взаимодействия антител с антигенами
- •Иммунопатология
- •Аллергия (гиперчувствительность)
- •Типы аллергических реакций
- •Приготовление и применение микробных аллергенов
- •Иммунодефициты
- •Трансплантационный иммунитет
- •Противоопухолевый иммунитет
- •Иммунный статус человека
- •Принципы иммунотерапии
- •Иммунные сыворотки
- •Титрование антитоксических лечебных сывороток.
- •Вакцины
- •Традиционные вакцины
- •Вакцины нового типа
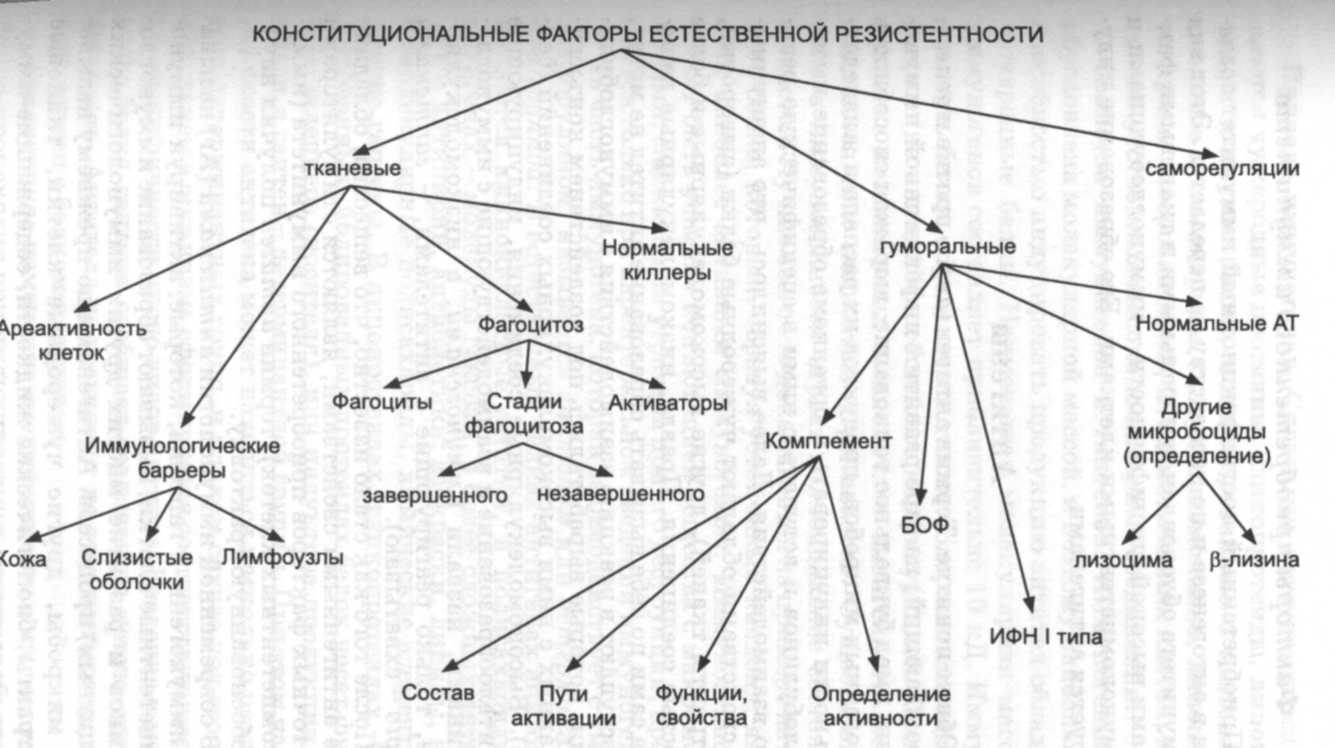
Конституциональные факторы естественной резистентности
Конституциональные факторы естественной резистентности организмов формировались в процессе длительной эволюции. Отличаются эти факторы защиты широким спектром антимикробного действия, элиминируя многочисленные виды микробов и их токсины. Более того, они обеспечивают не только антиинфекционный, но и противоопухолевый иммунитет, гомеостаз в целом.
Тканевые факторы
Среди тканевых факторов антиинфекционной защиты самую важную роль выполняют: ареактивность клеток; кожа, слизистые оболочки, лимфатические узлы как иммунологические барьеры; фагоциты и нормальные киллеры.
Клеточная ареактивность. Видовая реактивность клеток к патогенным микробам и токсинам обусловлена генотипом, который детерминирует образование на поверхности клеток соответствующих рецепторов. При их отсутствии адсорбция и проникновение инфекционного агента или яда в клетку будут невозможными. Генотипическая ареактивность связана также с дефицитом необходимых для микроба веществ, особым химическим составом отдельных структур и макромолекул клеток, избирательной специфичностью действия микробных ферментов. Клеточная ареактивность является очень стабильным видовым признаком, но все-таки может изменяться с возрастом или под действием различных факторов окружающей среды. Так, например, Л. Пастер показал наличие ареактивности птиц к сибиреязвенной инфекции, но при погружении их лапок в ледяную воду зараженные птицы заболевали вследствие резкого охлаждения организма. В другом классическом опыте И.И. Мечникова была отмечена природная нечувствительность лягушек, черепах, ящериц к столбнячному токсину. Развитие столбняка у пойкилотермных животных достигалось помещением их в термостат и повышением температуры тела.
Видовая ареактивность клеток постепенно развивается в процессе выздоровления от инфекционного заболевания или после вакцинации. В отличие от генотипической, приобретенная ареактивность носит специфический характер, сочетаясь с повышенной активностью иммунокомпетентных клеток.
Иммунологические барьеры. Кожные покровы и слизистые оболочки обеспечивают невосприимчивость как механические защитные барьеры и вследствие выделения антимикробных веществ широкого диапазона действия. Так, в отделяемом потовых и сальных желез кожи находят различные ингибиторы, молочные и жирные кислоты, угнетающие многие виды патогенных бактерий. Слизистая желудка секретирует соляную кислоту, в которой быстро инактивируется холерный вибрион. Многие слизистые оболочки продуцируют муколитический фермент лизоцим, вызывающий лизис или гибель ряда бактерий в результате разрушения клеточной стенки. В наибольших концентрациях лизоцим обнаруживается в секретах конъюнктивы и носа, в слюне и слизи кишечника.
Мощным естественным барьером являются лимфатические узлы. Проникновение в них патогенных бактерий приводит к возникновению воспалительного процесса, сопровождающегося освобождением из тканей биологически активных веществ, под влиянием которых происходит активация лейкоцитов, скапливающихся вокруг патогенных микробов и препятствующих их распространению в кровоток, подлежащие ткани и внутренние органы. Наряду с этим в очаге воспаления активируется фагоцитарная реакция.
Фагоциты и фагоцитоз. Защитную функцию клеток, способных поглощать и переваривать микробы, впервые показал И.И. Мечников, назвав их фагоцитами. Среди них он различал микрофаги - нейтрофилы, эозинофилы, базофилы, и макрофаги - моноциты крови, гистиоциты, эндотелиальные и ретикулярные клетки внутренних органов и костного мозга.
Различают завершенный и незавершенный фагоцитоз. Фагоцитарная реакция осуществляется поэтапно.
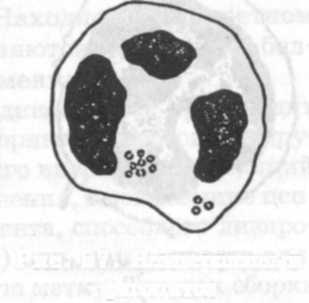
Завершенный фагоцитоз, заканчивающийся полным разрушением микроба, происходит в несколько этапов: 1) положительный хемотаксис, или приближение фагоцита к микробу; 2) адгезия, или прилипание фагоцита к нему; 3) инвагинация (впячивание) мембраны фагоцита с последующим формированием фагосомы и ее слияние с лизосо-мой; 4) киллинг-инактивация микроба в фаголизосоме, проявляющаяся набуханием, фрагментацией и его лизисом до низкомолекулярных соединений (рис. 56). Если микробные антигены разрушаются частично, вслед за фагоцитозом начинается антителообразование.

Некоторые виды микроорганизмов и особенно поглощенные вирусы проявляют большую устойчивость к лизосомальным антимикробным веществам или даже размножаются внутри фагоцитов (рис. 57). Такой незавершенный вид фагоцитоза чаще наблюдается в нейтрофилах и заканчивается их гибелью или фагоцитированные микробы выталкиваются из них. Нередко гранулоциты с размножившимися в них бактериями становятся объектом фагоцитоза для макрофагов. Следует подчеркнуть, что в отличие от нейтрофилов, которые поглощают и переваривают в основном истинные бактерии, макрофаги фагоцитируют спирохеты, актиномицеты, грибы, простейшие, вирусы, атрофирующиеся, омертвевшие или злокачественно перерожденные клетки.
Стимулируют фагоцитоз ингибиторы микробов и активаторы фагоцитов. К ним относятся нормальные антитела, специфические иммуноглобулины, цитокины, вызывающие положительный хемотаксис и повышающие метаболизм фагоцитов. Факторами, ускоряющими фагоцитоз, являются соли кальция, магния и другие электролиты, адреналин, гистамин, пирогенные вещества, анаболические гормоны. Угнетают фагоцитоз ацетилхолин, серотонин, антигистаминные вещества, такие как, например, димедрол, кортикостероиды, алкалоиды, катаболические гормоны.
Нормальные
(естественные) киллеры. NK-клетки
-специализированные большие лимфоциты
с рыхлым почковидным крупным ядром,
содержащие в обильной цитоплазме
митохондрии, свободные рибосомы с
элементами шероховатого
эндоплазматического ретикулума, аппарат
Гольджи и электронно-плотные гранулы
с большим количеством цитотоксических
веществ (рис. 58). Основным их отличием
является то, что на внешней мембране
они не имеют присущих В- и Т-клеткам
маркеров (специфических молекул) и
антигенраспознающих рецепторов (см.
«Иммунная система»). Специфическими
маркерами NK-клеток
являются молекулы CD56
и CD57
(claster
des-ignatio),
выявляемые
с помощью кластера (группы) моноклинальных
антител. Ее субфракцию К-клеток,
осуществляющих лизис клеток-мишеней,
обработанных антителами, маркирует
молекула CD16
или Fey,
являющаяся
рецептором иммуноглобулина G.
Кроме этого, на NK-клетках
определяются адгезивные молекулы и
С-лектин - белок-рецептор,
распознающий
углеводные остатки на клетках-мишенях,
которыми служат разного рода
трансформированные и быстро пролиферируемые
клетки. Их цитолиз осуществляется на
основе взаимодействия с углеводными
детерминантами делящихся клеток
(лектиновое распознавание) с последующим
выделением из гранул NK-клеток
белков-перфоринов и гранзимов (сериновых
п ротеиназ),
которые, проникая через поры в
клетках-мишенях, запускают программированную
гибель клеток (апоптоз) с сегментацией
ДНК и отделением хроматиновых фрагментов,
окруженных оболочкой. В крови NK-клетки
составляют 12 % от общего количества
лимфоцитов. Особенно много их в селезенке
(36 %), которая считается местом завершения
развития NK-клеток.
Имеются
они также в легких (5 %), лимфоузлах (3
%) и лимфоидных образованиях кишечника.
ротеиназ),
которые, проникая через поры в
клетках-мишенях, запускают программированную
гибель клеток (апоптоз) с сегментацией
ДНК и отделением хроматиновых фрагментов,
окруженных оболочкой. В крови NK-клетки
составляют 12 % от общего количества
лимфоцитов. Особенно много их в селезенке
(36 %), которая считается местом завершения
развития NK-клеток.
Имеются
они также в легких (5 %), лимфоузлах (3
%) и лимфоидных образованиях кишечника.
Гуморальные факторы
Гуморальные факторы иммунитета, обеспечивающие врожденную резистентность организма, очень многочисленны. Большинство из них обладают антимикробной активностью. Концентрация их в крови и лимфе здоровых людей невелика, но при инфицировании может резко возрастать. Обладают широким спектром действия, некоторые -синергическим и аддитивным, усиливающими микробо-цидные эффекты. Природа их многообразна, но, как правило, они являются полипептидами. Механизм антимикробного действия - многосторонний. Вырабатываются разнообразными клетками, главным образом Т-лимфоцитами и макрофагами, и нередко являются их активаторами.
Среди гуморальных факторов антиинфекционной защиты основное значение придают комплементу; действующим в сочетании с ним пропердину и интерлейкину-1 (ИЛ-1); белкам острой фазы воспаления и интерферону I типа.
Комплемент. Структурно сформированного комплемента (complementum - дополнение) как гуморального фактора иммунитета в организме здоровых людей и животных нет. В их крови циркулируют его компоненты (фракции, молекулы) - Clq, Clr, Cls, С2, СЗ ... С9, В, или СЗ-проактиватор, и ряд других. Находясь в дискретном (разобщенном) состоянии, они являются инертными белками-предшественниками комплемента.
Формирование
комплемента в единое целое происходит
при внедрении в организм болезнетворных
микробов или других антигенов. При
этом на основе его инертных субстанций
создаются ферментоподобные соединения,
вызывающие цепную реакцию образования
комплемента, способного лизировать
клетки (бактерии, эритроциты) или, чаще,
просто элиминировать генетически
чужеродную метку. Так как сборка
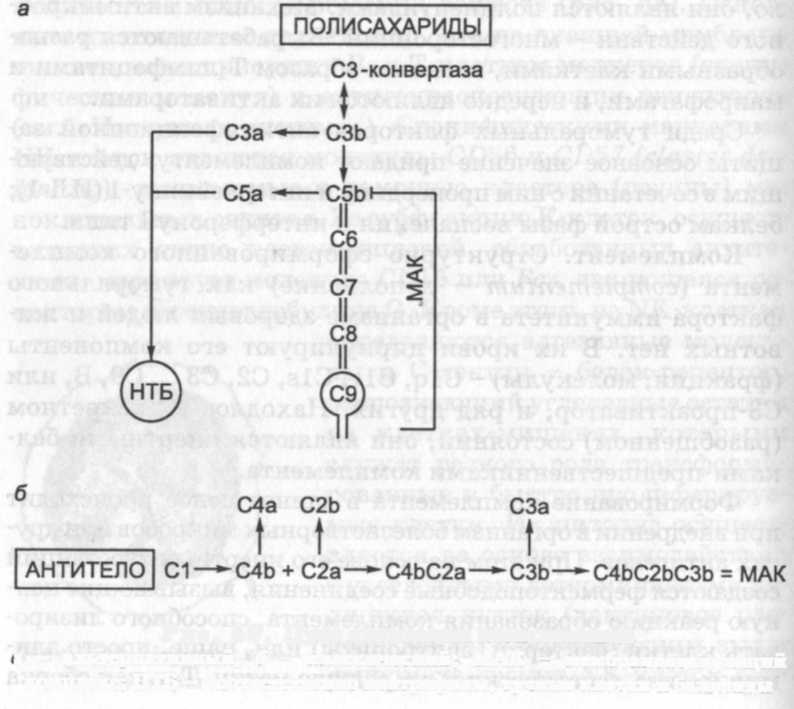
Пути активации комплемента. Различают классический и альтернативный пути. Первый из них инициируется иммунным комплексом антитело + антиген; другой, более редкий, - некоторыми полисахаридами и липополисахаридами бактерий без участия антител.
Поскольку комплемент - прежде всего, неспецифический фактор резистентности организма, то вначале рассмотрим активацию комплемента по альтернативному пути.
Альтернативный путь активации комплемента начинается с того, что на внешней мембране бактерии, проникшей в организм, адсорбируется комплексное соединение СЗЬВЬ, всегда присутствующее в очень небольших количествах в крови. Ввиду того что оно обладает исключительно высокой реакционной способностью расщеплять инертную СЗ-фракцию комплемента до активных субфракций СЗа и СЗЬ, ее называют также СЗ-конвертазой (рис. 59). Образованию следовых концентраций СЗ-конвертазы предшествует поэтапная диссоциация протеолитическими ферментами крови СЗ-фракции комплемента до СЗЬ-субфракции, а после присоединения к ней фактора В и последующего его расщепления до ВЬ инертное соединение СЗЬВ превращается в СЗЬВЬ-конвертазу.
Связывание конвертазы углеводами мембраны бактерии защищает ее от распада, что быстро происходит в крови. После дополнительной стабилизации защитным белком пропердином она расщепляет СЗ-фракцию комплемента. При этом к СЗ-конвертазе, связанной с мембраной микроорганизма, присоединяются реакционноспособные большие молекулы СЗЬ (малые СЗа-пептиды отщепляются), сообщая ей свойства С5-конвертазы.
На втором этапе с ними взаимодействуют молекулы С5, которые под влиянием С5-конвертазы тоже диссоциируют на С5Ь и маленькие пептиды С5а. На конечной стадии конструирования комплемента происходит образование мембраноатакующего комплекса (МАК). Начинается это с последовательного присоединения к полипептиду С5Ь фракций С6, С7, С8. Образовавшийся комплекс своей реакционной массой ориентирует проникновение в липидный бислой мембраны бактерии двух (нескольких) фракций С9. Заканчивается формирование МАК полимеризацией молекул С9 в кольцевую структуру, через канал которой в бактерию проникает вода и электролиты, что может приводить к ее лизису. Чаще комплемент не разрушает бактерии, а лишь ингибирует их, способствуя быстрому фагоцитозу, в частности обеспечивает адгезию, так как у фагоцитов имеются рецепторы к полипептидам СЗЬ, которые покрывают поверхность микробов. Кроме того, комплемент стимулирует фагоцитоз косвенным путем: посредством отщепляющихся при его активации пептидов СЗа и С5а, которые непосредственно воздействуют на нейтрофилы, усиливая их метаболизм и особенно - хемотаксис. Одновременно с этим они вызывают выброс из тучных клеток тканей и базофилов крови различных медиаторов, повышающих в очаге инфекции проницаемость сосудов для фагоцитов и ускоряющих фагоцитоз.
Классический путь активации комплемента инициируется антителом, вступающим в специфическую взаимосвязь с бактерией (рис. 59, б). Процесс сборки его компонентов начинается на антителе с последовательных объединений Clq, Or и Cls в одну стабилизированную ионами молекулу С1, обладающую протеолитической активностью в отношении С4-фракции комплемента. Ее расщепление ведет к образованию пептидов С4а+С4Ь и формированию в присутствии ионов Mg2+ соединения С4ЬС2, а после ферментативной диссоциации С2 - С4ЬС2а, аналогичного СЗ-конвертазе, вызывающей при диссоциации фракции СЗ образование комплекса С4ЬС2аСЗЬ, или С5-конвертазы классического пути. Последующие этапы активации комплемента вплоть до окончательного формирования МАК, такие же, как при альтернативном пути. Идентичны также механизмы прямого и опосредованного влияния комплемента на связанные с антителами бактерии, фагоцитоз и воспалительный процесс в целом.
Содержание комплемента в сыворотках колеблется в зависимости от вида и возраста животных, сезона и даже времени суток. Наиболее постоянный и высокий его титр регистрируется у морских свинок, поэтому именно их сыворотка используется как комплемент для постановки реакции связывания комплемента (РСК). У здоровых людей уровень комплемента варьирует незначительно, но у больных может резко повышаться или снижаться. Изучение титра комплемента в динамике позволяет составить представление о резистентности организма человека и прогнозе заболевания.
Система комплемента очень лабильна. Инактивация комплемента происходит в течение 2-4 дней даже при хранении сывороток в холодильнике, где температура не превышает 5 °С. Быстро разрушается комплемент под действием протеаз, на свету, особенно - при УФ-облучении, в слабых растворах кислот и щелочей. Исчезает комплементарная активность сывороток после прогревания при 56 °С в течение 20-30 мин.
Методы определения общей гемолитической активности комплемента. Действуя на микробы как литический фактор, комплемент повышает бактерицидную активность сыворотки крови. О содержании комплемента в сыворотке крови судят по его гемолитической активности в отношении эритроцитов барана, обработанных гемолизинами (см. РСК). Титр комплемента чаще всего выражают в минимальном количестве сыворотки, которое в нормальных условиях лизирует 50 % оптимально сенсибилизированных гемолизинами эритроцитов.
Определяя активность комплемента классического пути, исследуемую сыворотку крови разводят 1:10 изотоническим раствором хлористого натрия и в объемах от 0,05 до 0,5 мл вносят в 10 пробирок. Затем все объемы сывороток доводят электролитом до 1,5 мл, добавляя в каждый из них по 1,5 мг гемолитической системы (смесь равных объемов 3 %-ной взвеси бараньих эритроцитов и гемолитической сыворотки). Пробирки инкубируют при 37 °С 45 мин, охлаждают при 4 °С для остановки реакции и центрифугируют в течение 5 мин при 1500 об/мин, после чего определяют объем сыворотки, вызвавший лизис 50 % сенсибилизированных эритроцитов (условную гемолитическую единицу активности комплемента - СН 50). Затем рассчитывают количество СН 50 на 1 мл цельной сыворотки, которое у здоровых людей составляет 40-60 СН 50, что и является титром комплемента.
Точно так же определяют активность альтернативного пути комплемента, но вместо сенсибилизированных бараньих эритроцитов используют несенсибилизированные кроличьи эритроциты и изотонический раствор, содержащий Mg2+ без ионов Са2+, что блокирует классический путь активации комплемента.
Активность комплемента и его компонентов определяют также методом радиального гемолиза в агаровом геле. При этом гемолитическую систему смешивают с расплавленным агаром в соотношении 1:7 и быстро выливают в стерильные чашки Петри. После застывания агара в геле проделывают несколько лунок диаметром 4 мм и заполняют их испытуемыми сыворотками, помещая чашки в холодильник при 4 °С на 24 ч, а затем - в термостат на 60 мин для проявления зон гемолиза. Критерием активности комплемента служит квадрат диаметра зон гемолиза.
Белки острой фазы (БОФ). Это белки сыворотки крови, которые продуцируются в основном клетками печени в острой фазе воспаления под влиянием воспалительных цитокинов и, прежде всего, интерлейкина 1 (ИЛ-1), вызывающего повышение температуры тела (см. «Цитокины»). К ним относятся фибриноген, амилоидный протеин, а главное, С-реактивный (ЦР) и маннозосвязывающие (МН) белки. При этом, накапливаясь в крови, ЦРБ и МНБ активируют комплемент - первый по классическому и альтернативному пути, связываясь с фосфорилхолином грамположительных бактерий и обнажая в нем участки, способные взаимодействовать с отдельными фракциями комплемента, а второй - только по классическому пути, приобретая свойство расщеплять С4 и С2 фракции комплемента после связывания с остатками маннозы.
Интерферон I типа. Различают две серологические группы ИФНI типа (interfere - препятствую) - α и β. ИФНα -это семейство 20 гликопротеидов с молекулярной массой около 18 кД, ИФНβ - гликопротеид 20 кД. Отличаясь по структуре, они обладают одинаковым механизмом действия. В норме α-ИФН продуцируется мононуклеарными фагоцитами, а β-ИФН - фибробластами. Под воздействием инфекционного начала секретируются многими клетками, и в месте входных ворот инфекции их концентрация в считанные часы многократно возрастает. При этом интерферонообразование определяется некоторыми системами активации комплемента, в частности, пирогенное действие ИЛ-I и понижение рН в межклеточной жидкости на фоне повышения температуры усиливают продукцию ИФН. Механизм антивирусного действия ИФН I типа - многообразный. Под его воздействием в клетках индуцируется синтез двух ферментов: олигоаденилатсинтетазы и протеинкиназы. При этом первая катализирует 2,5-олигоадениловую кислоту, активирующую клеточные нуклеазы и разрушение вирусных иРНК, а вторая - фосфорилирует оссубъединицу инициирующего фактора трансляции и блокирует его, в результате чего вирионная иРНК утрачивает способность связываться с рибосомой. Антивирусный эффект интерферона посредством блокады трансляции проявится и в отношении клеточной иРНК, так как на фоне ингибирования пролиферации клеток репродукция вирусов замедляется или же прекращается. Кроме того, ИФН I типа усиливает литическое действие нормальных киллеров на клетки-мишени, индуцирует экспрессию антигенов МНС I класса и тем самым способствует распознаванию инфицированных вирусами клеток.
Другие микробоцидные факторы крови. Кроме комплемента, сыворотка крови человека содержит ряд других микробоцидных веществ различной природы. Так, ее бактерицидность, прежде всего, определяется концентрацией лизоцима - фермента с молекулярной массой около 15 кД. Наиболее чувствительны к нему грамположительные бактерии. Лизоцим вызывает гидролиз β(1-4)-гликозидаз-ной связи в молекуле пептидогликана, который является основным компонентом их клеточной стенки. При частичном разрушении пептидогликанового слоя эти бактерии (сферопласты) погибают, при полном (протопласты) - лизируются. Основной источник лизоцима в крови - макрофаги.
Таким же широким спектром действия, как лизоцим, обладают сывороточный фактор β-лизин и лейкины, освобождающиеся из лейкоцитов. Каждый из них и все вместе по эффектам антимикробного действия уступают комплементу и лизоциму.
Методы определения активности лизоцима и β-лизина. Микробоцидное действие лизоцима определяют по отношению к Micrococcus lysodeikticus, а β-лизина - к Bacillus subtilis. Тест-микробы смешивают с расплавленным и охлажденным до температуры 45-50 °С агаром и быстро выливают его в чашки Петри. В застывших слоях агара выбивают лунки, которые заполняются сывороткой. Диффундируя из лунок, лизоцим и fi-лизин вызывают радиальный лизис тест-культур вокруг лунок. Их активность определяют по калибровочному графику в зависимости от квадрата диаметра зон бактериолиза.
Незначительный вклад в бактерицидную активность сыворотки крови вносят ингибиторы бактерий с узким спектром антибактериального действия, как-то: эритрин, ингибирующий коринебактерии дифтерии, туберкуло-статический фактор и др. Антивирусное действие проявляют сывороточные термолабильные β-ингибиторы - липопротеины, которые активируются специфическим микроглобулином. Уровень содержания всех этих гуморальных факторов антиинфекционной защиты в основном определяется питанием. Однако есть неспецифические антимикробные факторы крови, концентрация которых отчетливо повышается под воздействием инфекционных агентов. К ним относятся пропердин и нормальные антитела.
Пропердин. Как и комплемент, пропердин — сложный белок, обладающий антибактериальной активностью (pro и perde — подготовлять, разрушать). Состоит из пяти компонентов, три из них - специфические, а два - СЗ- и В-фракции — такие же, как у комплемента. Стабилизируя комплемент, пропердин обусловливает альтернативный, или, иначе, пропердиновый путь его активации. Действуя совместно с комплементом, он вызывает лизис бактерий (клеток), усиливает фагоцитарную реакцию и воспалительный процесс.
Нормальные антитела. Уже давно было известно, что в сыворотке крови новорожденных могут содержаться антитела к различным видам микроорганизмов. По структуре они ничем не отличаются от иммунных, приобретенных в процессе инфекции, идентичны с ними и по механизму взаимодействия с микробами, т. е. реагируют по закону строгой специфичности. Их близкое сходство с иммуноглобулинами вызывало острые дискуссии по проблеме нормальных антител. Установлено, что образование нормальных антител генетически запрограммировано, они экспрессируются на поверхностных мембранах незрелых В-лимфоцитов в виде рецепторов. Будучи цитофиль-ными, нормальные антитела обнаруживаются в крови новорожденных в очень низких титрах, как правило, в цельной сыворотке. Уровень свободноплавающих нормальных антител в крови возрастает в результате повышения их продукции В-лимфоцитами под воздействием микроба как пускового сигнала.
Факторы саморегуляции. В основе антиинфекционного иммунитета лежит также способность организма к саморегуляции. Эта форма иммунитета, прежде всего, проявляется повышением температуры тела, губительно сказывающейся на жизнедеятельности многих бактерий и, особенно, вирусов в результате непосредственного влияния или изменения окислительно-восстановительного потенциала и рН пораженных тканей. Большое значение в обеспечении естественного иммунитета имеет усиление выделительных функций организма, выведение микробов и токсинов с мокротой, испражнениями, мочой и другими экскретами. Эти и другие, еще не учтенные факторы и механизмы общефизиологического характера находятся под регулирующим влиянием нейрогуморальных и гормональных функций организма.
Факторы приобретенного иммунитета
Приобретенный постинфекционный иммунитет создается в онтогенезе и по наследству не передается. Этот вид иммунитета обусловлен гуморальными и тканевыми факторами высокой специфичности - иммуноглобулинами и иммунокомпетентными клетками. Его образование индуцируется антигенами.
