
- •Введение
- •Лабораторная работа № 1 Определение скорости перерождения и степени тридимитизации кварцитов в процессе обжига
- •Основные понятия
- •Кремнезем и его полиморфные превращения
- •Методика проведения работы
- •Определение истинной плотности образцов
- •Результаты взвешиваний и расчетов истинной плотности кварцитов
- •Основные понятия
- •Методика проведения работы
- •Метод падающего шара (метод Стокса)
- •Метод вращающегося цилиндра
- •Метод растяжения стеклянного образца
- •Описание установки
- •Методика проведения работы
- •Значения цены деления шкалы окуляра в плоскости объекта
- •Результаты опыта и расчетов
- •Лабораторная работа № 4 Исследование склонности расплавов к стеклообразованию
- •Основные понятия
- •Составы и температуры эвтектик в некоторых бинарных и тройных системах
- •Методика проведения работы
- •Лабораторная работа № 5 Изучение системы с ограниченной взаимной растворимостью компонентов в жидкой фазе
- •Основные понятия
- •Методика проведения работы
- •Составы смесей
- •Лабораторная работа № 6 Кинетика гетерогенных процессов, протекающих при синтезе силикатных материалов
- •Основные понятия
- •Методика проведения работы
- •Расчет состава исходной смеси
- •Соотношения компонентов
- •Результаты опыта и расчетов
- •Лабораторная работа № 7 Кинетика спекания смесей на основе стекла
- •Основные понятия
- •Методика проведения работы
- •Составы спекаемых смесей
- •Результаты опыта и расчетов
- •Лабораторная работа № 8 Расчетные методы построения кривых ликвидуса
- •Основные понятия
- •Методика проведения работы
- •Расчет кривых ликвидуса по уравнению Шредера-Ле-Шателье
- •Расчет кривых ликвидуса по уравнению Эпстейна - Хоуленда
- •Примеры решения задач
- •Результаты расчетов
- •Задачи для самостоятельного решения
- •Двухкомпонентные системы
- •Библиографический список
- •Физическая химия тугоплавких неметаллических и силикатных материалов
- •308012, Г. Белгород, ул. Костюкова, 46.
Лабораторная работа № 5 Изучение системы с ограниченной взаимной растворимостью компонентов в жидкой фазе
Цель работы: изучение диаграммы состояния системы с ограниченной взаимной растворимостью в жидком состоянии в зависимости от состава исходных шихт и температуры.
Оборудование и материалы: ступка фарфоровая с пестиком: пять фарфоровых тиглей емкостью 50 – 30 мл; муфельная печь; ZnO; Н3ВО3; поляризационный микроскоп.
Основные понятия
Под системой понимают вещество или смесь веществ, отделенное от окружающей среды таким образом, что в нем можно наблюдать изменения и конечные состояния в зависимости от определяющих условий.
Фазой называется однородная часть системы с одинаковыми физическими, химическими и термодинамическими свойствами. Соседние фазы образуют друг с другом поверхность раздела и их можно отделить друг от друга механическим путем. Различают чистые (простые) фазы, например, химические соединения определенного состава, и смешанные фазы (газообразные, жидкие фазы, твердые растворы) – состав которых при изменении равновесия может меняться.
Под числом компонентов данной системы понимается наименьшее число индивидуальных химических соединений, через которые могут быть выражены составы любой фазы этой системы.
Степень свободы – это независимые термодинамические параметры системы, находящейся в устойчивом равновесии, которые могут изменять свои значения в некотором интервале без изменения числа и природы фаз. Под числом степеней свободы понимается наименьшее число независимых параметров, необходимых для определения состояния системы.
По числу степеней свободы различают нонвариантные (инвариантные), моновариантные, дивариантные и мультивариантные состояния систем.
Для тугоплавких силикатных систем, в которых давление газовой фазы над твердыми фазами можно рассматривать как постоянную величину, правило фаз Гиббса выражается уравнением:
![]()
где F – число степеней свободы; Р – число фаз; К – число компонентов. В настоящее время в большинстве простых силикатных и других оксидных системах обнаружены области расслоения (ликвации) в широких пределах температур и концентраций как стабильные, так и метастабильные.
В результате существования несмешиваемости в жидком состоянии или тенденции к ней наблюдается аномальный ход кривой ликвидуса на диаграмме состояния, т.е. наличие горизонтального участка или изгиба на ней. Области ликвации на диаграммах состояния ограничиваются бинодальными кривыми. В пределах этих областей в равновесии находятся две жидкости.
В соответствии с принятой классификацией возможно существование двух типов диаграмм состояния с областями расслаивания; твердая фаза может быть химическим соединением или одним из компонентов системы (рис. 5.1 и 5.2)
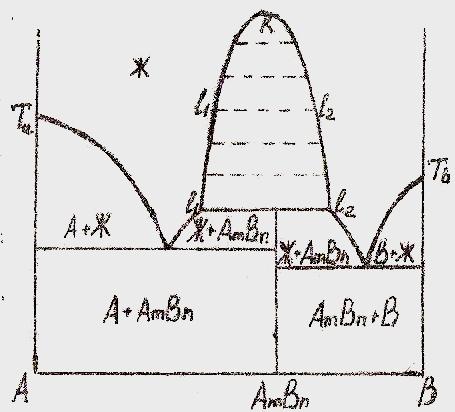
Рис. 5.1. Диаграмма состояния бинарной системы с ограниченной растворимостью компонентов в жидкой фазе при наличии химического соединения
Фигуративная
точка кристаллической фазы в первом
случае лежит между двумя сосуществующими
жидкостями (см. рис. 5.1), и для реализующегося
в системе процесса, называемого
синтектическим,
реакция
протекает по схеме
![]() ,
а во втором случае – по одну сторону из
них, для этого процесса, называемого
монотектическим
характерна
схема (рис.5.2).
,
а во втором случае – по одну сторону из
них, для этого процесса, называемого
монотектическим
характерна
схема (рис.5.2).
Выяснение
природы ликвационных явлений в силикатных
системах, основанное преимущественно
на принципах кристаллохимии, впервые
было предпринято Б. Уорреном и А. Пинкусом.
Причиной несмешиваемости они считают
образование катионом-модификатором
самостоятельных катион-кислородных
группировок, отличающихся от
кремнекислородных. Возникновение двух
различных группировок с образованием
двух жидкостей происходит только
при достаточно большой энергии связи
катиона с кислородом. Прочность этой
связи определяется различными
выражениями:
![]()
![]()
![]()
![]() где z
–
валентность: r
–
радиус катиона; n
– координационное число катионов и
может в определенной мере характеризовать
способность катиона вызывать
несмешиваемость расплава.
где z
–
валентность: r
–
радиус катиона; n
– координационное число катионов и
может в определенной мере характеризовать
способность катиона вызывать
несмешиваемость расплава.
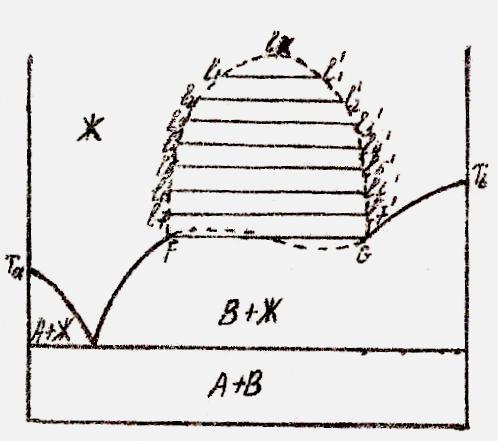
А мас. % В
Рис.5.2. Диаграмма состояния системы с ограниченной растворимостью компонентов в жидкой фазе
Если при растворении МеО в SiO2 силы взаимодействия катиона с кислородом слабее сил взаимодействия кремния с кислородом, то все ионы кислорода от МеO перейдут к SiO2, расплав будет состоять из ионов металла и (SiхOу)z- и расслаивания не произойдет.
Такое
явление наблюдается в расплавах,
содержащих катионы с радиусом больше,
чем радиус кислорода (![]() ), или характеризующиеся меньшим
зарядом по сравнению с ионом О2-
(
), или характеризующиеся меньшим
зарядом по сравнению с ионом О2-
(![]() ).
).
Расслоение, как правило, не наблюдается в силикатных системах,
содержащих
Be2+
(![]() ),
А13+
(
),
А13+
(![]() ),
В3+
(
),
В3+
(![]() ),
вследствие близости сил взаимодействия
этих элементов и кремния с кислородом.
В этом случае Si4+,
Me2+-,
Me3+
могут взаимно заменять друг друга и
образовывать с кислородом общие
катион-кремнекислородные группы.
),
вследствие близости сил взаимодействия
этих элементов и кремния с кислородом.
В этом случае Si4+,
Me2+-,
Me3+
могут взаимно заменять друг друга и
образовывать с кислородом общие
катион-кремнекислородные группы.
При
сильном взаимодействии катиона с
кислородом, как это отмечается в
расплавах силикатов Mq2+
(![]() ),
Fe2+
(
),
Fe2+
(![]() ),
Мn2+
(
),
Мn2+
(![]() ),
Са2+
(
),
Са2+
(![]() ),
Sr2+
(
),
Sr2+
(![]() ),
только небольшая часть ионов кислорода
переходит к SKX,
основная же масса их окружает катион,
образуя обособленные группы разного
состава: при этом жидкость становится
микрогетерогенной и расслаивается.
),
только небольшая часть ионов кислорода
переходит к SKX,
основная же масса их окружает катион,
образуя обособленные группы разного
состава: при этом жидкость становится
микрогетерогенной и расслаивается.
Э.А. Есин. подчеркивая необходимость для реализации расслаивания значительного содержания SiO2 в расплаве, связывает такую необходимость с двумя условиями:
1. Конденсация кремнекислородных тетраэдров должна произойти до такой степени, чтобы значительно облегчился переход возникающих группировок в аналогичные области почти чистого кремнезема, т.е. при образовании расслаивания структуры аниона (SiхOу)z- должна описываться как сдвоенными цепочками кремнекислородных тетраэдров (Si4O11)6-, так и плоскостями, составленными из них (Si4O10)4--.
2. С уменьшением количества атомов кислорода, приходящегося на один атом Si, отрыв кислорода от комплексов (SiхOу)z- все более затрудняется и происходит без расслаивания жидкости до тех пор, пока конденсация тетраэдров не зашла слишком далеко, т.е. пока основные формы кремнекислородных радикалов представлены кусками цепочек (SiхOу)z- и кольцами (Si3O9)6-.
Е. Левин и С. Блок считают первой причиной ликвации стремление катионов стеклообразователя и модификатора в расплавах стеклообразующих веществ формировать собственные катион-кислородные координационные полиэдры. Если полиэдры модификатора и стеклообразователя сходны по форме и размерам, то несмешиваемость не наступает. Если же такого сходства между полиэдрами нет, то в зависимости от относительной силы связи конкурирующих катионов возникает либо несмешиваемость, либо метастабильное состояние системы, выражением которого является горбообразный вид кривой ликвидуса.
Краткий обзор причин ликвации силикатных систем, описывающий это явление с различных точек зрения, показывает отсутствие принципиальных расхождений по вопросу о природе и механизме фазового ликвационного распада. Более того, имеющиеся представления дополняют друг друга.
Взяв за основу наиболее общие и универсальные данные, мы увидим, что основной первичной причиной возникновения несмешиваемости следует принять электростатическое силовое взаимодействие между ионами расплава, которое вызывает стремление двух различных катионов организовать вокруг себя самостоятельные кислородные полиэдры. Но для того, чтобы в результате такого стремления наступило фазовое разделение, нужны соответствующие условия.
Это с одной стороны, определенная степень силы взаимодействия катион-кислород, с другой – структурная несовместимость возникающих различных катион-кислородных группировок, причем структурная характеристика последних зависит, в свою очередь, от степени поляризации анионов, т.е. кислорода.
Различные сочетания или взаимные наложения этих двух факторов: силового и структурного приводят к большей или меньшей степени реализации расслоения или тенденции к расслоению. В общем виде тенденция к расслоению определяется размером ликвационной области на диаграмме состояния, причем независимо от того, стабильна она или нестабильна.
Следует иметь в виду, однако, что сейчас невозможно установить зависимость между размером области ликвации и указанным суммарным эффектом. Поэтому для оценки расплавов, склонных к расслаиванию, используют только энергетические параметры катионов.
Ликвационные явления играют весьма существенную роль в технологических процессах. Изменяя условия тепловой обработки, можно в очень широких пределах регулировать размеры, взаимное распределение и состав микрофаз.
Зная закономерности влияния различных факторов на структуру образовавшихся материалов и влияние этой структуры на практически важные свойства материалов, можно уверенно решать многие сложные технические задачи.
