
- •Спектроскопія атомів і молекул
- •58012, Чернівці, вул.. Коцюбинського, 2.
- •Лабораторна робота № 1 Вивчення спектрів лужних елементів
- •1. Теоретична частина
- •1.1. Загальні положення теорії атомів
- •Спектри лужних елементів
- •2. Експериментальна частина
- •2.1. Вимірювальна установка та методика вимірювання
- •2.2. Порядок виконання роботи
- •3. Контрольні питання
- •4. Рекомендована література
- •Лабораторна робота № 2 Вивчення спектрів лужноземельних елементів
- •1. Теоретична частина
- •2. Експериментальна частина
- •2.1. Вимірювальна установка та методика вимірювання
- •2.2. Порядок виконання роботи
- •3. Контрольні питання
- •4. Рекомендована література
- •Лабораторна робота № 3 Дослідження складного ефекту Зеємана
- •1. Теоретична частина
- •3.1. Схема спостереження ефекту Зеємана
- •2. Експериментальна частина
- •2.1. Вимірювальна установка та методика вимірювання
- •2.2. Порядок виконання роботи
- •1. Теоретична частина
- •2. Експериментальна частина
- •2.1. Вимірювальна установка та методика вимірювання
- •2.2. Порядок виконання роботи
- •3. Контрольні питання
- •4. Рекомендована література
- •Лабораторна робота № 5 Спектроскопія комбінаційного розсіювання світла
- •1. Теоретична частина
- •1.1. Явище комбінаційного розсіювання світла
- •1.2. Класична теорія комбінаційного розсіяння світла
- •1.3. Квантова теорія комбінаційного розсіяння світла
- •2. Експериментальна частина
- •2.1. Вимірювальна установка та методика вимірювання
- •2.2. Порядок виконання роботи
- •3. Контрольні питання
- •4. Рекомендована література
- •Перелік використаних джерел
2. Експериментальна частина
2.1. Вимірювальна установка та методика вимірювання
Експериментальне дослідження структури коливного спектра двоатомної молекули дозволяє визначити характеристики коливного руху її ядер – частоти коливань і константу ангармонізму, а також величину енергії дисоціації.
Для цього світловий пучок променів від джерела білого світла (наприклад, лампи кіноапарату) пропускають через кювету з газом (у даній роботі – з парами йоду) і проектують на вхідну щілину спектрографа ДФС-13 (рис. 4.3). Розкладений у спектр оптичною системою спектрографа світловий потік потрапляє на фокальну площину камерного об’єктива спектрографа ДФС-13. Положення спектральних ліній реєструється за допомогою фотоплівки.
За виглядом одержаного коливного спектру визначають різниці хвильових чисел ліній двох сусідніх послідовних переходів (вторинні різниці)
![]() .
(4.14)
.
(4.14)

Рис. 4.3. Оптична схема вимірювальної установки
1 – джерело; 2, 2'– оптичні лінзи; 3 – кювета з парами йоду; 4, 4' – дзеркала; 5 – вхідна щілина спектрографа; 6 – дзеркальний об’єктив; 7 – дифракційна решітка; 8 – фокальна площина фотокамери.
З (4.14) видно, що вторинні різниці є однаковими для довільних сусідніх спектральних ліній. Тоді, з (4.10) одержуємо
![]() ,
(4.15)
,
(4.15)
а з (4.14) – константу ангармонізму
![]() .
(4.16)
.
(4.16)
Для знаходження енергії дисоціації візьмемо до уваги, що при необмеженому зростанні коливного квантового числа υ внаслідок збіжності рівнів і малості χ << 1 має місце наближена рівність
![]() .
(4.17)
.
(4.17)
Тоді використовуючи
(4.8) можна одержати
![]() ,
а з (4.13) – енергію дисоціації
,
а з (4.13) – енергію дисоціації
![]() .
(4.18)
.
(4.18)
Отже, для визначення енергії дисоціації необхідно експериментально визначити хвильове число та константу ангармонізму χ. Знаючи ці величини, можна знайти параметри De та α.
2.2. Порядок виконання роботи
1. Ознайомившись з установкою, зарядити у затемненій кабіні касету фотоплівкою.
2. Під керівництвом викладача увімкнути живлення кінопроекційної лампи.
3. За допомогою лінзи 2 досягти якнайкращої освітленості кювети з йодом, при цьому зображення джерела проектується в площину лінзи 2’. За допомогою лінзи 2' та дзеркала 4 сформувати чітке зображення торця кювети на вхідній щілині спектрографа.
4. Візуально спостерігати структуру коливного спектра молекул йоду. У цьому експерименті для фотографування спектра поглинання йоду використовується джерело (кінолампа), що дає випромінювання у видимій області, для якої кванти світла hν > E∞1 відповідають переходам з основного у збуджений електронний стан молекул йоду (рис. 4.2).
5. Встановити касету у площину реєстрації. Зняти спектр йоду при двох експозиціях (час експозиції задає викладач; залежить від потужності лампи і чутливості фотографічного матеріалу). Ширина вхідної щілини 180мкм. Щілина обмежується по висоті діафрагмою Гартмана. Касета переміщується по вертикалі за допомогою підйомного механізму на дві поділки при кожній експозиції.
6. Розмістити перед лінзою 2’ ртутну лампу (джерело спектру порівняння). Рівномірно освітити щілину за допомогою лінзи 2’ і поротного дзеркала 4. Сфотографувати спектр ртуті. Зйомку зробити таким чином, щоб спектр ртуті розмістився між двома спектрами йоду.
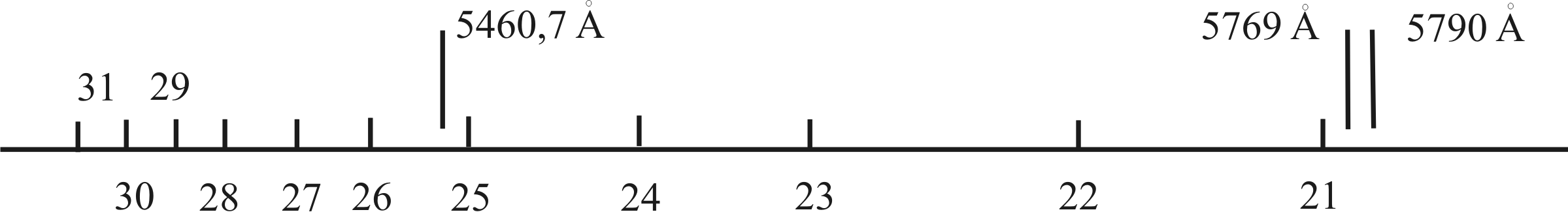
Рис. 4.4. Положення ліній у спектрі поглинання йоду (у першому збудженому електронному стані) відносно ліній ртуті
7. Обробити відзняту фотоплівку. Час проявлення 7 хвилин, час закріплення – 10 хвилин. Оцінити її придатність до розшифровки спектра, показати викладачеві. Встановити плівку на вимірювальний мікроскоп ІЗА-2. Зелена лінія ртуті λ0 = 5460,7 Å знаходиться між коливальними переходами υ' = 25 і υ' = 26 збудженого електронного стану (ближче до υ' = 26)
8. Визначити обернену дисперсію спектрографа за формулою
(Å/мм),
де λ1 і λ2 – відомі довжини хвиль двох спектральних ліній ртуті, а l1 і l2 – відповідні цим лініям значення поділок на шкалі мікроскопа ІЗА-2.
9. Зняти відліки по мікроскопу для десяти коливальних переходів (симетрично розподілених відносно зеленої лінії ртуті λ0=5460,7Å), від υ = 21 до υ = 30. Одночасно зняти відлік для зеленої лінії ртуті. Розрахувати довжини хвиль, що відповідають заданим коливальним переходам
![]() .
.
10. За знайденими
значеннями λυ
обчислити відповідні хвильові числа
![]() ,
виразивши їх у см-1.
,
виразивши їх у см-1.
11. Знайти відстані між сусідніми рівнями (первинні різниці):
![]() .
.
12. Обчислити вторинні різниці
![]() .
.
13. Користуючись формулою (4.15), обчислити основне коливне хвильове число молекули йоду у збудженому електронному стані.
14. Користуючись формулою (4.16), обчислити константу ангармонізму молекули йоду у збудженому електронному стані.
15. Користуючись формулою (4.18), обчислити енергію дисоціації D2 молекули йоду у збудженому електронному стані, виразивши її у ерг. Дж, еВ.
16. За відомими значеннями основного коливного хвильового числа і енергії дисоціації обчислити параметри потенціалу Морзе De і α.
17. Використовуючи знайдені значення параметрів потенціалу Морзе De і α, а також величну рівноважної відстані між ядрами молекули йоду R0 = 2,66 Å, за допомогою програмного продукту типу Mathcad або Origin побудувати графік залежності енергії її першого збудженого стану від відстані відповідно формули (4.6).
18. Візуально підрахувати кількість обертальних рівнів між коливальними рівнями з квантовими числами υ = 24 і υ = 25 або υ = 25 і υ = 26.
19. Користуючись формулою (4.7), знайти кількість обертальних рівнів між вибраними коливними і порівняти із знайденими візуально (для розрахунків взяти R0 = 2,8 Å; атомна маса йоду 127 а.о.м.,
1 а.о.м. =·∙1,66∙10-24 г).
20. Оформити звіт, навівши у ньому назву, номер і мету роботи, перелік обладнання, реферативно – необхідні відомості з теоретичної частини, схему вимірювальної установки, таблицю з результатами вимірювань, обчислення шуканих величин, графік кривої Морзе, висновок про ступінь ангармонізму і значення експериментально знайдених параметрів молекули йоду, оцінку точності запропонованого методу та можливу область використання його результатів.
