
- •1 Закон тд для закр. Неподвиж. Сис-мы.
- •1Ый з-н термодинамики для закрытой подвижной системы
- •I з-н тд для открытой системы(стационарного поточного процесса.
- •2Ой з-н термодинамики:
- •Круговые проц или Циклы :
- •Дросселирование газов
- •Необратимые термодинамические процессы
- •Обратимые и необрат процессы
- •ПОлитропные процессы ид.Газа
- •Термич.Поле. Градиент температуры.
- •Механизмы и законы переноса теплоты. Явление теплопроводности, теплоотдачи и излучения.
- •Тепловая хар-ка обратимых циклов.
- •Теплообмен излучением
- •Основные понятия ти
- •Законы теплообмена излучения.
- •1.Физ. Условия теплообмена конвекцией.
- •2,Факторы, определяющие интенсивность конвективного теплообмена.
- •Теплоптоводность ч/з многослойную цил-ую стенку.
- •Теплоптоводность ч/з цил-ую стенку.
- •Цикл Карно (цк). Теорема Карно.
- •2Ой случай
- •3Ий случай
- •Цикл Отто.
- •Цикл Дизеля.
- •Теплопередача через многослойную цилиндрическую стенку.
- •Критический диаметр тепловой изоляции трубопровода.
- •Факторы определяющие интенсивность конвективного теплообмена.
- •Числа подобия процессов конвективного теплообмена.
Необратимые термодинамические процессы
Если процесс необратим то энтропия рабочего тела увеличивается за счет внутреннего производства энтропии.
Согласно
![]() ;
;![]() т.к.
т.к.![]() след-но конечные состаяния в обратимом
и необратимом процессе будут различны
из-за различных конечных значений
энтропии
след-но конечные состаяния в обратимом
и необратимом процессе будут различны
из-за различных конечных значений
энтропии![]()
![]()
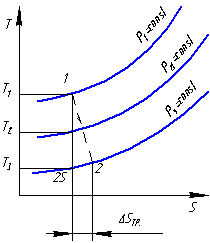
Рассмотрим обратимый процесс 1-2s и необратимый 1-2 адиабатного расширения рабочего тела до одного и того же давления. Необратимость обусловлена трением , для
![]()
видно что из-за
перехода части работы в теплоту трения
![]() .
.
Для вычисления
![]() заменим процесс 1-2 на два обртимых проц-а
заменим процесс 1-2 на два обртимых проц-а![]() и
и![]() .
Проц.
.
Проц.![]() -
изоэнтропный, а
-
изоэнтропный, а![]() -
изотермический. В изоинтропном
-
изотермический. В изоинтропном![]() =0,
а в изотермическом
=0,
а в изотермическом![]() .
Рассмотрим необратимый процесс расширения
газа в вакуоме
.
Рассмотрим необратимый процесс расширения
газа в вакуоме
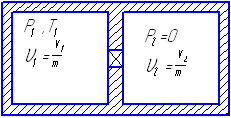
Сосуд теплоизолирован
(адиабатная система) после расширения
газа
![]() ;dq=0
и
;dq=0
и
![]() ;du=0
;du=0
![]() или
или![]() след-но процесс расширения является
изотермическим. Для изотермического
проц-а увеличение энтропии в системе
равно
след-но процесс расширения является
изотермическим. Для изотермического
проц-а увеличение энтропии в системе
равно
![]() т.е. из-за необратимости
процессов внутри системы произойдет
производство энтропии.
т.е. из-за необратимости
процессов внутри системы произойдет
производство энтропии.
Обратимые и необрат процессы
В термодинамике сист хар-ся с помощью физ-х вел или переменны. Если переменные принимают устойчивые значения, то сист нах-ся в определенном сост. Поэтому переменные системы наз её параметрами состояния. Термодинамическое сост сист опысивают внут параметрами сост. Сист нах-ся в равновесном сост если при изоляции её от воздействия внешной сферы среды параметры сост сист не изменяются. Поэтому равновесное сост сист может изменится только вследствие внш воздействмя. Процесс при котором изм-ся сост сист наз-ся термодинамическим процессом. Карно вел понятие идеализированный процесс.таким процессом яв-ся обратным процессом . Если система в которои протекает про_сс вернуть в начальное стояние так что во внешней среде не произойдет каких-либо изменений то процесс называется обратным . В пративном случае он называется необратимым . Обратный процесс сост из последовательности равновесных состояний . М/у которыми отсутствует диссипативный эффект . В реальности квази статические изменения состоят и при отсутствие диссипативный эффект не наблюдается но обратный процессы очень важны в термодинамике т.к харак-ся потери мех-ой энергии . Поэтому их можно использовтаь в качестве эталона при оценке эффективности в реальных процессов мех-х устройств.
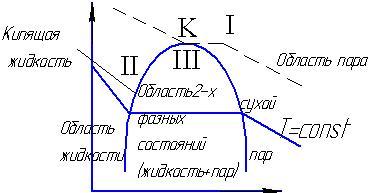 Реальные газы
Все реальные газы явл. Парами соответствующих
жидкостей.изобразим в pv
различные состояния газа:точка К
критическая точка,кот. Соответств.
Критич параметры:Pкр.Tкр.Vкр.При
критич состоянии исчезают различия
между жидк и паром.I-газообразное
состояние,II-некипящ
жидкость,III-двухфазное
состояние(кип жидк+сух пар).При t>tкр
газ ни при каком давлении не может
сконденсироваться.Для расчета параметров
реальн газа часто используют уравн
Вандер-Ваальса
Реальные газы
Все реальные газы явл. Парами соответствующих
жидкостей.изобразим в pv
различные состояния газа:точка К
критическая точка,кот. Соответств.
Критич параметры:Pкр.Tкр.Vкр.При
критич состоянии исчезают различия
между жидк и паром.I-газообразное
состояние,II-некипящ
жидкость,III-двухфазное
состояние(кип жидк+сух пар).При t>tкр
газ ни при каком давлении не может
сконденсироваться.Для расчета параметров
реальн газа часто используют уравн
Вандер-Ваальса![]()
где a/V^2
поправка на внутр давление,обусловл внутр притяжением молекул.b-поправка на обьем самих молекул.
Это уравнение
качественно правильно описывает непрерыв
переход из жидк состояния в
газообразное.Уточнение расчетов пытались
обеспечить,за счет зависимостей:![]() и
и![]() .В
настоящее время тоеритич обосновано
уравнение состояния в виде
.В
настоящее время тоеритич обосновано
уравнение состояния в виде![]()
Где z
фактор сжимаемости.![]() -
вириальные коэф.,учитывающие взаимодействия
соотв 2.3…молекул.Вириальные коэф.
Определяются на основе знания зависимости
-
вириальные коэф.,учитывающие взаимодействия
соотв 2.3…молекул.Вириальные коэф.
Определяются на основе знания зависимости![]() взаимодействия молекул от расстояния
между ними.
взаимодействия молекул от расстояния
между ними.
