
- •1 Закон тд для закр. Неподвиж. Сис-мы.
- •1Ый з-н термодинамики для закрытой подвижной системы
- •I з-н тд для открытой системы(стационарного поточного процесса.
- •2Ой з-н термодинамики:
- •Круговые проц или Циклы :
- •Дросселирование газов
- •Необратимые термодинамические процессы
- •Обратимые и необрат процессы
- •ПОлитропные процессы ид.Газа
- •Термич.Поле. Градиент температуры.
- •Механизмы и законы переноса теплоты. Явление теплопроводности, теплоотдачи и излучения.
- •Тепловая хар-ка обратимых циклов.
- •Теплообмен излучением
- •Основные понятия ти
- •Законы теплообмена излучения.
- •1.Физ. Условия теплообмена конвекцией.
- •2,Факторы, определяющие интенсивность конвективного теплообмена.
- •Теплоптоводность ч/з многослойную цил-ую стенку.
- •Теплоптоводность ч/з цил-ую стенку.
- •Цикл Карно (цк). Теорема Карно.
- •2Ой случай
- •3Ий случай
- •Цикл Отто.
- •Цикл Дизеля.
- •Теплопередача через многослойную цилиндрическую стенку.
- •Критический диаметр тепловой изоляции трубопровода.
- •Факторы определяющие интенсивность конвективного теплообмена.
- •Числа подобия процессов конвективного теплообмена.
Дросселирование газов
Процесс понижения давления газа при прохождение через препятствие называется дросселированием. Снижение давления газа является следствием потерь на трение и вихреобразование из-за этого процесс дросселирования относится к необратимым процессам. Часть кинетической энергии после диафрагмы преобразуется в теплоту. Контрольную поверхность с рабочим телом между сечениями 1-1 и 2-2 можно считать адиабатной системой. В процессе дросселирования изменения скорости W=W2-W1
поэтому из ф.:
![]() при g=0
и
при g=0
и
![]() ,
,![]() .
.
Изменение температуры после дросселирования газа называется дроссель-эффектом Джоуля-Томсона. В идеальном газе энтальпия зависит только от температуры, поэтому для идеального газа эффект Джоуля-Томсона равен нулю (Т2=Т1). В реальном газе энтальпия дополнительно зависит от давления:
![]() т.к.
т.к.
![]() , то
, то![]() поэтому
поэтому
![]() ;
;![]() -дифференциальный эффект дросселирования.
-дифференциальный эффект дросселирования.
В термодинамике
доказывается что
![]() ,
поэтому величина дифференциального
эффекта дросселирования равна:
,
поэтому величина дифференциального
эффекта дросселирования равна:![]()
Используя ур.
Ван-дер-Ваальса:
![]() можно получить
можно получить![]()
или
![]() .
Температура при которой эффект
дросселирования отсутствует (dT=0)
называется температурой инверсии
.
Температура при которой эффект
дросселирования отсутствует (dT=0)
называется температурой инверсии
![]() .
Используя значение критической
температуры для реального газа
.
Используя значение критической
температуры для реального газа![]() можно найти отношение:
можно найти отношение:![]()
![]() .
ТКР-
температура в кретической точке на
кривой PV.
Т.к. при дросселировании dP0,
то знак
.
ТКР-
температура в кретической точке на
кривой PV.
Т.к. при дросселировании dP0,
то знак
![]() будет зависить от знака
будет зависить от знака![]() или от отношения температур
или от отношения температур![]() в соответствии с этим различают 3 случая:
в соответствии с этим различают 3 случая:
1)Положительный дроссель-эффект
![]() >0
: при dT<0
или T<TИНВ2)Отрицательный
д.-э.
>0
: при dT<0
или T<TИНВ2)Отрицательный
д.-э.
![]() :
приdT>0
или T>
TИНВ
3) Нулевойд.-э.
:
приdT>0
или T>
TИНВ
3) Нулевойд.-э.
![]() :
приdT=0
или T=TИНВ
:
приdT=0
или T=TИНВ
Изменение знака дроссель эффекта называется инверсией. Температура TИНВ
большинства газов (кроме Н и Не) достаточно велики, поэтому процессы дросселирования обычно идут с понижением температуры (dT<0)
![]() При снижении
давления изменение температуры газа
определяется интегральным дроссель-эффектом
Джоуля-Ленца
При снижении
давления изменение температуры газа
определяется интегральным дроссель-эффектом
Джоуля-Ленца
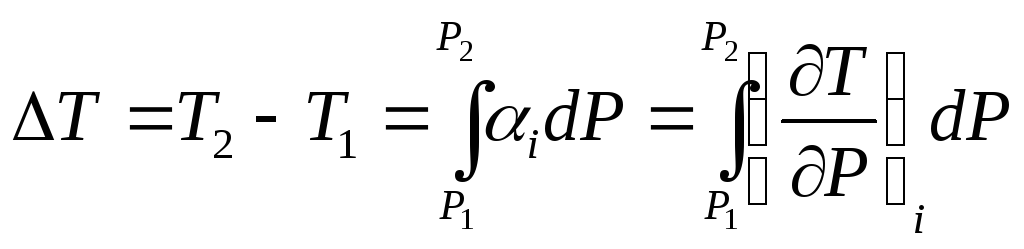
ТП через многослойную тонкую стенку.

На границах стенки заданы ГУ 3-го рода
При х=х0 t=tf1 , α= α1
При х=хn t=tf2 , α= α2
При ГУ 3-го рода можно записать:
При х=х0 q= α1*(tf1- tw1) (1.26)
При х=хn q= α2*(tf2- tw2)
Плотность теплового потока через стенку определяется по формуле
q=
(tw1-
tw(n+1))/![]()
Из нее найдем tw1-
tw(n+1)
= q*![]() ,
а из (1.26)
,
а из (1.26)
tw1-
tw(n+1)
= tf1-tf2-q*(1/
α1+1/
α2).
Из последних 2-х уравнений найдем
плотность теплового, исключив tw1
и tw(n+1):
q=(tf1-tf2)/(
1/ α1+1/
α2+![]() )
)
q=k*(tf1-tf2)
(1.27), где k=1/(1/
α1+1/
α2+![]() )
(1.28) k
– коэффициент теплопередачи. 1/k
– общее термическое сопротивление.
)
(1.28) k
– коэффициент теплопередачи. 1/k
– общее термическое сопротивление.
1/k=
1/ α1+1/
α2+![]() (1.29)
(1.29)
Общее термическое сопротивление.
1/ α1
и 1/ α2
внутренних термических сопротивлений
отдельных слоев
![]() и контактных термических сопротивлений
между ними
и контактных термических сопротивлений
между ними
![]() .
Температуры крайних поверхностей стенки
определяются из равенств (1.26). Температуры
отдельных поверхностей получатся из
формул q=
(tw1-
tw(n+1))/
.
Температуры крайних поверхностей стенки
определяются из равенств (1.26). Температуры
отдельных поверхностей получатся из
формул q=
(tw1-
tw(n+1))/![]() и tw3=
tw1-
q*
и tw3=
tw1-
q*![]() =tw1-q*(
=tw1-q*(![]() )
после определения температур крайних
поверхностей tw1
и tw(n+1).
)
после определения температур крайних
поверхностей tw1
и tw(n+1).
Если стенка одна, то n=1 и Rk1=0. В этом случае k=1/( 1/ α1+ δ/λ + 1/ α2)
2ой З-н термодинамики: На основание опытов установлена что все реальные процессы могут самопроизвольно протикать только в одном направление например теплота переходит от теплого тела к холодному газ вытекает только из сосуда с высоким давлением вокруг пространства к непод-му газу в сосуде можно только подвести работу вала.2-щй З-н основан на опыте и может быть сформулирован в виде принципа не обратимости .Все естественные и реальные проц-ы не обратные .. Это означает что в природе нет проц-в которые можно была бы в отношение всех их результатов полностью обратить . Т.е вернуть в начальное состояние без остаточных измерений в окружающей среде . Принцип не обратимости в термод-ке часто заменяется на частные формолеровки как например Планк предложил 2-ой закон формоли-ки . Все процессы соправаждающейся трением не обратимы . Клаудиус утверждал что не возможно передать теплоту от более холодного тела к более теплому . Если одновременно не произвести свазанные с этих другое измерение . Щчень часто при расмотренние 2-го З-на термо используется постулаты основные на частных соображениях а работе тепловых двигателей . Согласно Томсану не возможен процесс единственный результат кот-го состоял в поглащение теплоты от нагревателя и полном преобразование этой теплоту в работу . Планк утверждал что не возможно построить периодически действительную машину единственным результатом действие которое было бы совершение механической работы за счет оплатнение теплового резервуара. Для получение полезной работы или для переноса теплоты от холодного источника к горячему необходимо компенсирование процесса . Круговые проц или Циклы :
Процесс возвращается в систему в начальное состаяние наз-ся круговым процессом . Цикл состаящий из обратных процессов наз-ся обратным . Если цикл протекает по движению часовой стрелки -1-2-3-4-1 то его наз прямым . В противоположном случае 1-4-3-2-1 наз обратным . В цикле с стационарным циркулированием рабочим телом поток вещества протикает через последовательно включенные открытые системы для этих систем справедлив 1 –ый З-н термо. q12-l12 = i*2-i*1 +g(z2-z1) q23-l23 = i*3-i*2 +g(z3-z2) q34-l34 = i*4-i*3 +g(z4-z3) q41-l41 = i*1-i*4 +g(z1-z4)
Сложим их получим :q12+q32+q34+q41=l12+l23+l34+l41 Следовательно суммарная полезная работа цикла =знергие подводной к рабочему тело в форме теплоты полученой как разность отведенных теплот другим словом можно сказать – В циклах знергии подводимая к рабочему телу в форме теплоты частична прев полезную работу и частица отводится в форме теплоты . в формуле пркдпологалось что что сумма qij >0 . те в частных процессах теплоты подведено > чем отведено такие циклы соответ-но тепловым машин если сумма qij <0 то сумма lij <0 . След-но суммарная полезная работа будет подводится в цикле . Такие цикли соответствуют тепловым насосам и холодным установкам . В тепловых Маш рабочие тело осущ-т всегда прямой кругавой процесс . А в тепловых насосах обратный . Эффек-ть цикла тепловой Маш можно определить с помощью термо КПД Mt=lц/q = q1-q2/q1 = 1-q2/q1 Где l ц = сумма lij =работа цикла Q1 q2 – удельныя подведенная и отвед теплота (q1-q2= сумма qij)
