
- •Ответы на вопросы по курсу «биохимия» для студентов II курса бакалавриата
- •Методы определения первичной структуры белков.
- •Методы определения пространственной структуры белка.
- •Классификация и номенклатура ферментов.
- •Влияние ингибиторов на активность ферментов.
- •Жирорастворимые витамины.
- •Метаболизм холестерола.
- •Биосинтез пуриновых нуклеотидов.
- •Биосинтез пиримидиновых нуклеотидов.
- •Доказательства генетической роли днк.
- •Посттранскрипционная регуляция генной экспрессии.
- •Особенности структуры тРнк как адапторной молекулы.
- •Механизм действия стероидных гормонов.
Метаболизм холестерола.
С
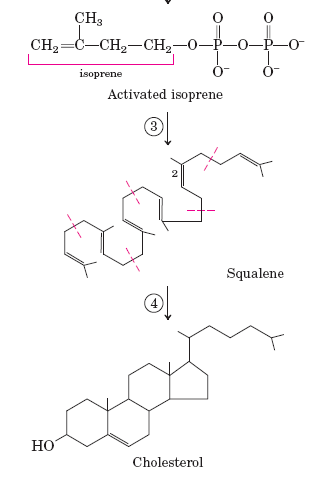 интез:
интез:
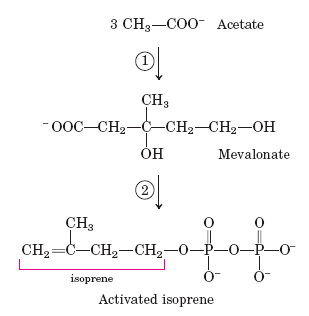
1 — комплекс реакций :
2ацетил-СоА ---ацетил-СоА-ацетилтрансфераза--->ацетоацил-СоА
ацетоацил-СоА + ацетил-СоА → ГМГ-СоА-синтаза → гидроксиметилглутарил-СоА
ГМГ-СоА → ГМГ-СоА-редуктаза → мевалонат
2 — участие АТФ
3 — НАДФН-зависимая конденсация
4 — скваленоксидаза
Из холестерина образуются желчные кислоты (холевая, литохолевая, дезоксихолевая) и стероидные гормоны.
Высокоэнергетические соединения. Классификация, химическая природа. АТФ, ее структура и биологическая роль.
Макроэргические соединения способны накапливать и передавать энергию в ходе реакции. При гидролизе одной связи высвобождается более 20 КДж/моль энергии. По химическому строению макроэрги — чаще всего ангидриды фосфорной и карбоновых кислот, а также слабых кислот, какими являются тиолы и енолы.
Классификация макроэргов по связям:
Фосфоангидридная связь — АТФ, ГТФ и их аналоги; dG — 32кДж/моль
Тиоэфирная связь — ацетил-СоА, сукцинил-СоА; dG — 34 кДж/моль
Гуанидинфосфатная связь — креатинфосфат; dG — 42 кДж/моль
енолфосфатная связь — фосфоенолпируват; dG — 54 кДж/моль
ацилфосфатная связь — 1,3-дифосфоглицерат; dG — 46 кДж/моль
АТФ — аденозинтрифосфорная кислота — имеет следующую структуру: остаток рибозы соединен с аденином и тремя остатками фосфорной кислоты. При отщеплении одной связи образуется 32 кДж/моль энергии.
АТФ — энергетическая валюта клетки. Непосредственным источником АТФ являются процессы субстратного (реакции гликолиза, реакция ЦТК сукцинил-СоА → сукцинат) и окислительного фосфорилирования. Генерация мембранных потенциалов Н+ и Na+, используемых для окислительного фосфорилирования, осуществляется в процессе транспорта электронов в дыхательной цепи энергосопрягающих мембран.
Энергия разности потенциалов может обратимо превращаться в энергию АТФ (с помощью АТФ-синтаз). Будучи макроэргическим соединением, АТФ выполняет функцию аккумулирования биоэнергии и ее последующего использования для выполнения клеточных функций.
Макроэргичность возникает за счет высокой плотности зарядов, сконцентрированных в хвосте молекулы, обеспечивающей легкость диссоциации терминального хвоста при водном гидролизе. Это обеспечивает высокую величину свободной энергии гидролиза терминального фосфата АТФ в водной среде.
Пути синтеза АТФ. Субстратное и окислительное фосфорилирование. Роль митохондрии в синтезе АТФ.
АТФ синтезируется в процессах субстратного и окислительного фосфорилирования.
Тканевое дыхание — это распад органики в живых тканях, сопровождающийся потреблением молекулярного кислорода и приводящий к выделению СО2 и Н2О и образованию биологических видов энергии. Это конечный этап превращений моносахаридов, в который на ранних стадиях включаются другие сахара, ЖК,АК и нуклеиновые основания.
Итоговая реакция — C6H12O6 + 6O2 → 6CO2 + 6H2O +2780 кДж/моль
В настоящее время биоокисление — это совокупность реакций окисления субстратов в живых клетках, основная функция которых — энергетическое обеспечение метаболизма.
Образование молочной кислоты без участия О2 — С6Н12О6 = 2С3Н6О3 + 65 кДж/моль
В аэробных условиях продукты бескислородного окисления становятся субстратами ЦТК, в ходе которого образуются восстановленные дыхательные переносчики — НАДФН, НАДН и флавиновые коферменты. Они способны переносить Н, т. к. в их структуре есть амид никотиновой кислоты.

При этом в молекулу НАД+ включается 1 протон и 2 электрона, второй протон остается в среде.
В ФАД и ФМН присоединяются и 2 электрона, и 2 протона — активная часть молекулы изоаллоксантиновое кольцо.
Дыхательная цепь — источник АТФ — расположена во внутренней мембране митохондрий (у эукариот), у бактерий — в цитоплазме или мезосомах.
Окислительное фосфорилирование. Основные переносчики электронов при окислительном фосфорилировании.
Молярные соотношения компонентов дыхательной цепи постоянны, ее компоненты встроены в митохондриальную мембрану в виде 4 белково-липидных комплексов:
I — НАДН-СоQH2-редуктаза — окисляет НАДН, отбирая у него 2 электрона и перенося их на растворимый в липидах убихинон, который внутри мембраны диффундирует к комплексу III. К тому же, комплекс I перекачивает 4 протона в межмембранное пространство из матрикса митохондрии
II — сукцинат-CoQ-редуктаза — не перекачивает протоны, но обеспечивает вход в цепь дополнительных электронов за счет окисления сукцината
III — СоQH2 — цитохром с-редуктаза — переносит электроны с убихинола на два водорастворимых цитохрома с на внутренней мембране митохондрии. Убихинол передает 2 электрона, а цитохромы за один цикл переносят по одному электрону. Туда же переходят 2 протона убихинола и перекачиваются комплексом
IV — цитохром-а-цитохромоксидаза — катализирует перенос 4 электронов с 4 молекул цитохрома на О2 и перекачивает 4 протона в межмембранное пространство
Участники:
Если субстрат окисления — альфа-кетокислоты, то в переносе электронов на НАД+ участвуют липоатсодержащие дегидрогеназы; в противном случае перенос электронов происходит непосредственно на НАД+. НАДН в дыхательной цепи окисляется НАДН-дегидрогеназой, содержащей ФМН и FeS и прочно связанной с дыхательной цепью
СоQ (убихинон) — способен находиться и в окисленном, и в восстановленном состоянии, как любой хинон. Служит коллектором восстановительных эквиввалентов, поставляемых в цепь через флавиновые дегидрогеназы. Его больше, чем других компонентов
железосерный белок — негемовое железо FeS. Со стадии ФМН путь электронов и протонов разделяется — первые накапливаются в матриксе митохондрий, а вторые идут на переносчики — CoQ и цитохромы.
Цитохромы — это гемопротеины, простетическая группа которых близка к гему.
Этапы цепи:
НАДН ↔ Комплекс I → ФМН, FeS. АДФ + Ф → АТФ
ФМН, FeS ↔ Q → развилка:
Q ↔ Комплекс II ↔ ФАД, FeS ↔ сукцинат — конец одной ветви цепи
Q ↔ Комплекс III ↔ цитохром b, FeS, цитохром с1. АДФ + Ф → АТФ
цитохром b, FeS, цитохром с1 ↔ цитохром с ↔ комплекс IV ↔ цитохром а, цитохром а3, Cu → O2. АДФ + Ф → АТФ
Цитохром а3, которым все кончается — это цитохромоксидаза, окисляющая цитохром с с образованием воды. Одна молекула О2 взаимодействует с двумя электронами цепи.
Окислительное фосфорилирование. Молекулярная организация системы окислительного фосфорилирования; ферментативные комплексы.
Молекулярная организация и комплексы - было раньше
Компоненты (восстановленная/окисленная форма):
НАДН + Н+ /НАД+
ФАДН2 / ФАД+
убихинол СоQ-H2/ убихинон
цитохромы b, c1, c, a, a3 (Fe2+/Fe3+)
H2O/ ½ O2
Хемиосмотическая теория Митчела о сопряжении окисления с фосфорилированием.
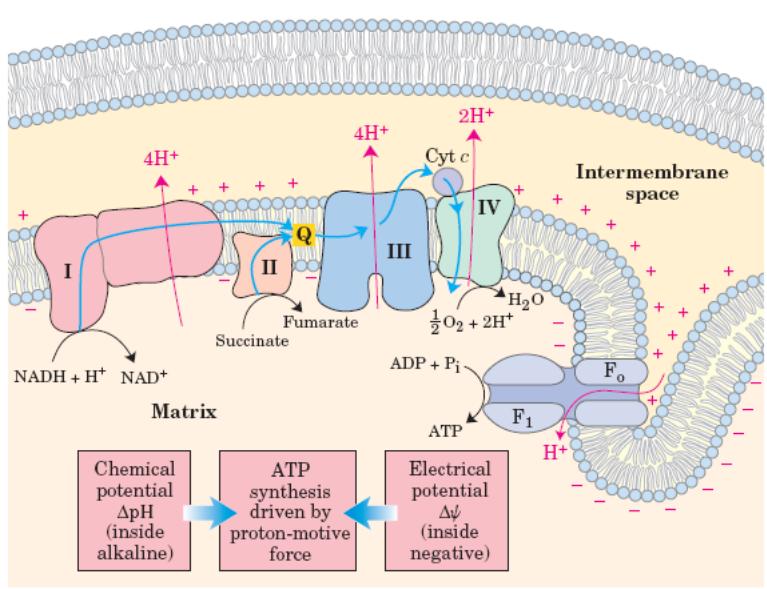
Функция дыхательной цепи — это утилизация восстановленных дыхательных переносчиков, образующихся в реакциях метаболического окисления субстратов (ЦТК). Соединения подключаются в цепь по возрастанию своих потенциалов.
В дыхательной цепи происходит дискриминация протонов и электронов — в то время как протоны переносятся через мембрану, создавая dpH, электроны движутся по цепи переносчиков от убихинола к цитохромоксидазе, генерируя разность электрических потенциалов, необходимую для образования АТФ протонной АТФ-синтазой. Т.о. Тканевое дыхание «заряжает» митохондриальную мембрану, а окислительное фосфорилирование «разряжает» ее.
Разность потенциалов на митохондриальной мембране, создаваемая дыхательной цепью, которая выступает в качестве молекулярного проводника электронов, является движущей силой для образования АТФ и других видов полезной биоэнергии. Механизмы этих превращений описывает хемиосмотическая концепция Митчелла.
Согласно ей, движение электронов по дыхательной цепи — это источник энергии для транслокации протонов через митохондриальную мембрану. Возникающая при этом разность потенциалов приводит в действие АТФ-синтазу, катализирующую реакцию АДФ+Ф → АТФ.
В дыхательной цепи есть только 3 участка, где перенос электронов сопряжен с накоплением энергии, которого хватит для образования АТФ, на других этапах разности потенциалов недостаточно.
Синтез АТФ в системе окислительного фосфорилирования. АТФ-синтаза.
АТФ-синтаза прикреплена ко внутренней мембране митохондрии Fo-трансмембранным доменом. F1 — домен в матриксе. Fo — гидрофобный белковый комплекс, имеющий внутри два полуканала для прохождения протонов. В состав Fo входит одна субъединица а, две копии b и 9-12 копий с.
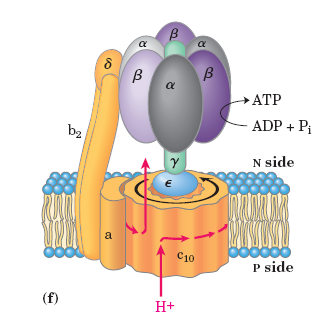
Синтез АТФ связан с изменением конформации синтазы при связывании ее с АДФ и Ф, вызываемым вращением гамма-субъединицы (выступает из F1 в сторону F0). Открытое состояние ----+АДФ, Ф---> свободное состояние → тесное состояние (синтез АТФ) — открытое состояние.
Разобщение дыхания и фосфорилирования. Ингибиторы ЭТЦ.
Эффективность окислительного фосфорилирования в митохондриях — это отношение АТФ к поглощенному кислороду.Экспериментально оно оказывается меньше 3. Значит, окислительное фосфорилирование, в отличие от субстратного, не является процессом, в котором окисление полностью сопряжено с образованием АТФ.
Степень сопряжения зависит от целостности мембраны митохондрии, оберегающей разность потенциалов, возникающую от транспорта электронов. Соединения, обеспечивающие протонную проводимость — это разобщители.Процесс разобщения контролируют гормоны.
Несопряженное дыхание обеспечивает поддержание температуры тела выше температуры среды.
Клетки реагируют на интенсивность клеточного метаболизма и поддерживают запасы АТФ на необходимом уровне. Это свойство — дыхательный контроль.
Ингибиторы ЭТЦ:
I комплекс — барбитураты, ротенон, пиерицидин
II комплекс — малонат
III комплекс — антимицин А, миксотиазол, стигмателлин
IV комплекс — сероводород, цианиды, угарный газ, NO
Ингибиторы АТФ-синтазы — олигомицин и атрактилозид.
Свободно-радикальные процессы в клетке. Антиоксиданты и ферменты антиоксидантной защиты.
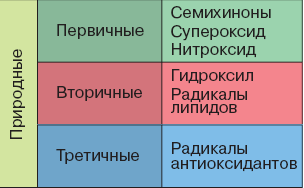
Атом кислорода, в отличие от молекулы, является радикалом — на внешнем уровне 1 электрон.
Свободное окисление (окисление чужеродного без образования АТФ) протекает при участии активных форм кислорода, образующихся при одноэлектронном восстановлении.
Эти реакции протекают в активном центре соответствующих ферментов, а промежуточные продукты не появляются во внешней среде. Образуется супероксид-анион кислорода. Он может образовываться и под действием УФ-лучей, НАДФН-оксидазы и при взаимодействии с железом — металлом переменной валентности.
О2- - высокореакционное соединение, накапливающееся в цитоплазме и активирующее NO-синтазу (образуется NO*) или превращающее NO* в ONOOH (апоптоз). Все радикалы вызывают (цепное) окисление белков, липидов, НК, углеводов.
Защита:
фермент супероксидлисмутазапревращает О2- в Н2О2 — субстрат каталазы или миелопероксидазы — образуется OCl-, OH* (также образуется при действии Fe2+ на Н2О2 - разрушение НК и т. д.)
природные или синтетические (бутилгидрокситолуол) растворимые антиоксиданты добавляют один электрон к активному радикалу, снижая его активность — таурин (связывает OCl-), карнозин (нейтрализует ОН*), ферритин (связывает активное железо), токоферол (прерывает перекисное окисление липидов).
Положительные свойства радикалов — участие в иммунитете, индукция апоптоза, образование медиаторов воспаления, индукция цепных реакций.
Структура и номенклатура нуклеотидов. Минорные нуклеозиды и нуклеотиды. Биологическая роль нуклеотидов.
Нуклеотиды — это мономеры НК, единицы мутации.
Нуклеотиды включают в себя основание, углевод и фосфорный остаток. Основание+углевод — это нуклеозид.
Азотистые основания бывают двух типов:
п
 уриновые
(аденин и гуанин)
уриновые
(аденин и гуанин)

пиримидиновые (урацил, цитозин, тимин)



Азотистые основания обладают кето-енольной таутомерией. Форма кетона устойчивее.
Номенклатура нуклеозидов (+углевод) — аденозин, гуанозин, уридин, цитидин, тимидин.
Номенклатура нуклеотидов - <корень>иловая кислота или <нуклеозид>монофосфат.
Если в составе дезоксирибоза — спереди пишут букву «д», если ее нет — в составе рибоза.
3' связь — углевод-азотистое основание, 5' связь — углевод-фосфорные остатки.
Обозначения — трехбуквенные и однобуквенные. Нуклеотиды обозначают по азотистому основанию в их составе. Иногда одна буква при секвенировании обозначает 2 равновероятных нуклеотида.
Углевод в нуклеотидах стабилен в экзо-2 и эндо-3 конформациях.
В пуриновых нуклеотидах осуществляется гликозидная связь между углеводом и основанием бетаN-1, в пиримидиновых — бетаN-9.
Есть и другой тип фосфорноэфирных связей в нуклеотидах — не только 5'. Существуют 2' и 3'-АМФ. У цАМФ 2'3' остаток фосфорной кислоты присоединяется ко 2 и 3 углеродным атомам рибозы, у цАМФ 3'5' — к 3му и 5му.
Помимоглавных пиримидиновых оснований — Ц, У, Т — в составе НК открыты минорные пиримидиновые основания. Это метилцитозины, дигидроурацил, псевдоурацил, 1-метилурацил, оротовая кислота и т. д. Минорные нуклеозиды этого ряда - дигидроуридин, риботимидин, псевдоуридин, тиоуридин и т. д.
Минорные нуклеозиды пуринового ряда — инозин, 7-метилгуанозин, ксантин, гипоксантин и т.д.
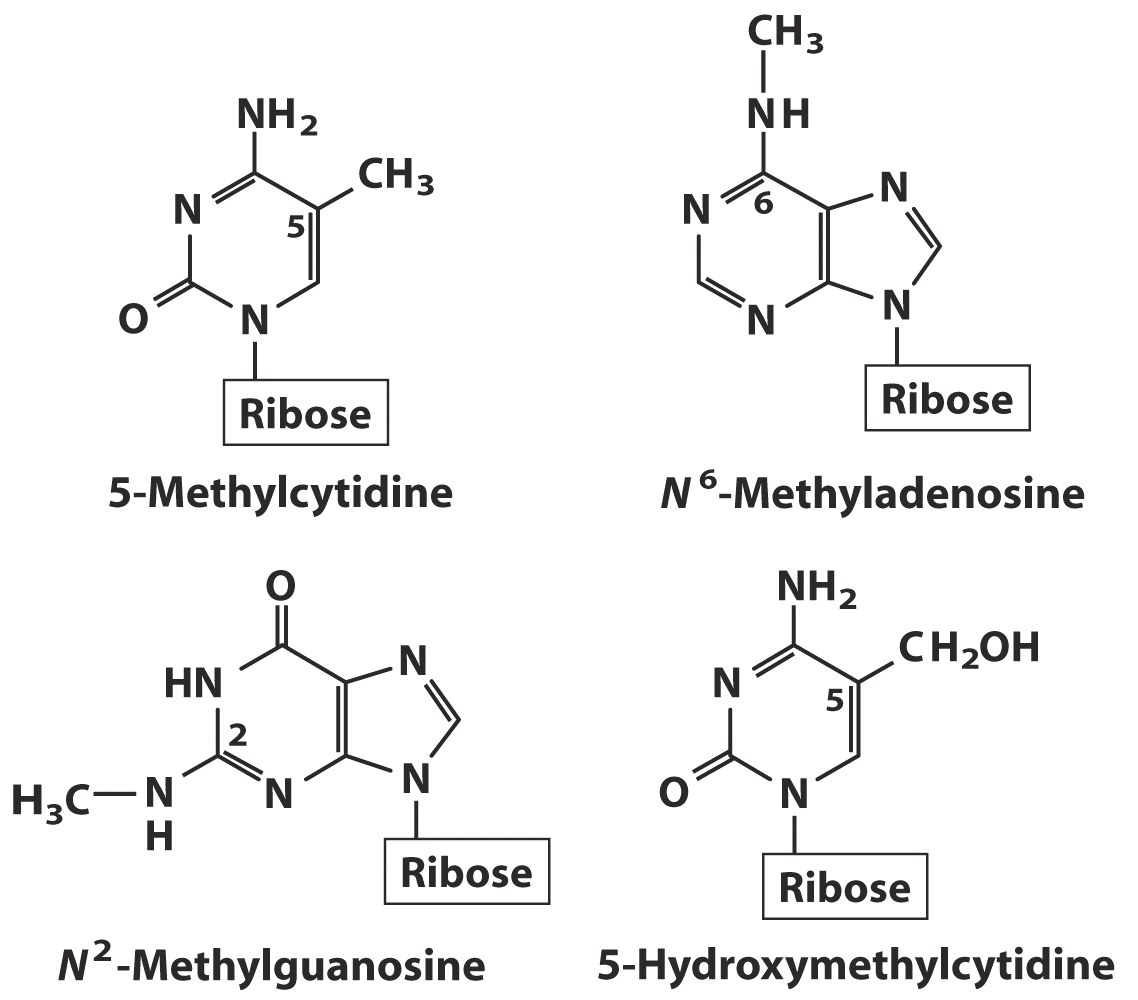
Азотистые основания в нуклеотидах способны вращаться вокруг гликозидной связи.
Биологическая роль нуклеотидов:
нуклеотидную структуру имеют многие коферменты (НАД+, ФАДН+, СоА, коферменты оксидоредуктаз и т.д.)
присоединяя фосфорные остатки, превращаются в нуклеозидтрифосфаты, которые могут быть основой для ферментативного синтеза НК или участвуют в биоэнергетике
цАМФ, цГМФ и т.д наделен рядом уникальных функций и высокой биоактивностью в регуляции процессов обмена, выполняет роль медиатора внеклеточных сигналов
в онкологии синтетические аналоги нуклеотидов используются для вызывания заметного цитотоксического эффекта клеток опухоли
