
- •Основы молекулярно-кинетической теории (мкт). Лекция 1
- •Лекция 2 Давление газа. Абсолютная температура. Молекулярно-кинетическое обоснование абсолютной температуры и давления. Измерение давления и температуры.
- •Лекция 3 Идеальный газ. Основное уравнение молекулярно – кинетической теории газов. Постоянная Больцмана. Температура и давление как статистические величины.
- •Лекция 4 Уравнение состояния идеального газа. Универсальная газовая постоянная. Основные газовые законы.
- •Лекция 5 Распределение скоростей молекул по Максвеллу. Измерение скоростей молекул. Опыт Штерна. Опытная проверка распределения молекул по скоростям.
- •Лекция 6 Газ в силовом поле. Барометрическая формула. Распределение Максвелла – Больцмана. Экспериментальное определение числа Авогадро.
- •Явления переноса в газах Лекция 7 Средняя длина и среднее время свободного пробега молекул. Явления переноса в газах. Диффузия.
- •Лекция 8 Внутреннее трение (вязкость газов). Теплопроводность газов.
- •Лекция 9 Теплопроводность и внутреннее трение при низких давлениях. Технический вакуум. Получение и методы измерения низких давлений
- •Лекция 11 Первое начало термодинамики. Применение I начала термодинамики к изопроцессам. Адиабатный процесс. Уравнение Пуассона. Скорость звука в газах.
- •Лекция 12 Политропический процесс. Теплоемкость. Принцип равномерного распределения энергии по степеням свободы и границы его применимости.
- •Лекция 13 Второе начало термодинамики. Невозможность создания вечных двигателей. Обратимые и необратимые процессы. Круговые процессы. Тепловые машины. Цикл Карно.
- •Лекция 14 Теоремы Карно. Реальные циклы. Приведенная теплота. Энтропия. Закон возрастания энтропии в изолированной системе.
- •Лекция 15 Статистический характер II начала термодинамики. Теорема Нернста. Недостижимость абсолютного нуля температуры.
- •Лекция 17 Внутренняя энергия реального газа. Эффект Джоуля-Томсона. Сжижение газов. Получение низких температур.
- •Лекция 19 Свойства жидкого состояния. Поверхностный слой. Поверхностное натяжение. Смачивание. Формула Лапласа. Капиллярные явления.
- •Лекция 20 Давление насыщенного пара над мениском. Растворы. Осмос. Осмотическое давление. Закон Вант-Гоффа.
- •Твердые тела Лекция 21 Аморфные и кристаллические тела. Анизотропия кристаллов. Классификация кристаллов по типу связей. Дефекты в кристаллах. Жидкие кристаллы.
- •Лекция 23 Плавление и кристаллизация. Диаграмма равновесия твердой, жидкой и газообразной фаз. Тройная точка.
- •Газодинамика Лекция 24 Основное уравнение газодинамики. Адиабатное течение газов. Критическая скорость.
- •Лекция 25 Движение со сверхзвуковой скоростью. Скачки уплотнения. Ударные волны. Число Маха. Реактивные двигатели. Многоступенчатые ракеты.
- •Литература:
Явления переноса в газах Лекция 7 Средняя длина и среднее время свободного пробега молекул. Явления переноса в газах. Диффузия.
Столкновения между молекулами играют очень важную роль во всех процессах, происходящих в газах. В частности, столкновения устанавливают равновесное распределение (Максвелловское) молекул по скоростям. Столкновения это и есть тот механизм, обеспечивающий переход газа к равновесному состоянию.
В идеальном газе столкновения происходят только между двумя молекулами. На одновременные столкновения между тремя и большим числом молекул можно не обращать внимания, так как они происходят достаточно редко. Столкновения молекул - случайные события. Их число зависит от скорости молекул, их размеров и концентрации. При столкновении молекулы сближаются до некоторого минимального расстояния, которое условно считается равным сумме радиусов молекул, взаимодействующих между собой.
Молекулы в этом случае надо представлять как твердые, упругие шарики с радиусами r1 и r2. Если газ однородный, то r1 = r2 = r. Столкновение между молекулами происходят только в случае, если их центры сближаются на расстояние равное сумме их радиусов r = r = 2r (рис.1).
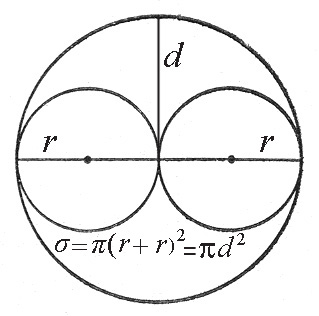
Рис.1. К расчету сечения рассеяния.
Иначе говоря, столкновение происходит только в том случае, если центры молекул окажутся внутри окружности площадью:
![]() (1)
(1)
Величина σ называется эффективным сечением рассеяния молекул, или просто сечением рассеяния. Величина d, то есть минимальное расстояние между центрами молекул при столкновении, называется эффективным диаметром молекулы.
В момент столкновения изменяется величина и направление скорости молекулы, после чего она движется прямолинейно до следующего столкновения. Расстояние, которое молекула проходит между столкновениями – случайная величина.
Среднее расстояние, которое молекула проходит между двумя последовательными столкновениями называется средней длиной свободного пробега молекул.
Число столкновений молекулы в единицу времени, очевидно, также является случайным.
Ее среднее значение называется средним числом столкновений молекулы в единицу времени.
Эти две связанные между собой величины – являются главными характеристиками процесса столкновения газовых молекул.
Определим эти величины. Предположим, что все молекулы газа неподвижны, кроме одной. Из-за столкновений с неподвижными молекулами она будет двигаться по ломаной линии (рис.2).
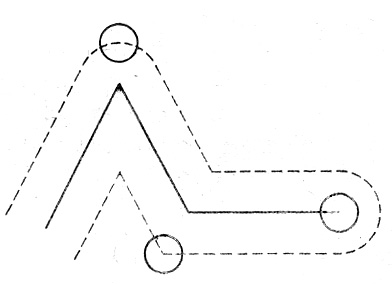
Рис.2. Траектория движения молекулы.
Пусть эффективный диаметр молекулы d. Она будет сталкиваться с теми неподвижными молекулами, центры которых находятся внутри цилиндра с площадью основания равной эффективному сечению рассеяния σ, т.е. окружности диаметром 2d (рис.3).
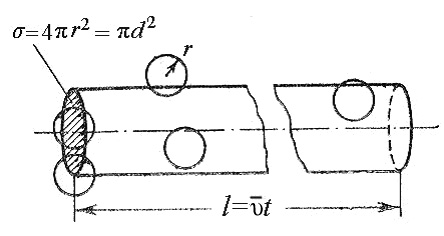
Рис.3. К расчету средней длины свободного пробега молекул.
Объем такого цилиндра равен пути, который молекула проходит за единицу времени, умноженному на σ:
![]()
где
![]() – средняя арифметическая скорость. Так
как t
= 1с то:
– средняя арифметическая скорость. Так
как t
= 1с то:
![]() (2)
(2)
Ошибка, которая допускается при замене ломаного цилиндра на прямой незначительная, так как длина каждого прямого отрезка много больше, чем диаметр цилиндра.
Умножим объем цилиндра на концентрацию молекул n. В результате получим число молекул, находящихся в цилиндре, таким же будет и число столкновений рассматриваемой молекулы в единицу времени.
![]() (3)
(3)
Однако следует учесть, что движется не одна, а все молекулы, поэтому число столкновений будет определяться не средней скоростью молекулы по отношению к стенкам сосуда (абсолютная скорость), а средней относительной скоростью (относительно движущихся молекул).
![]() (4)
(4)
Пусть до столкновения молекулы движутся со скоростями υ1 и υ2 (рис.4).
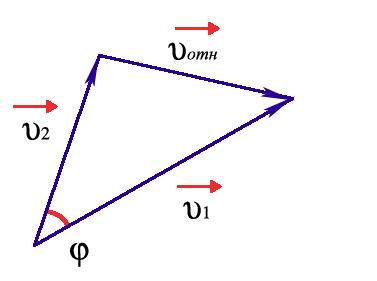
Рис. 4. К расчету относительной скорости.
Относительная скорость движения одной молекулы относительно другой:
![]()
Из рисунка видно, что:
![]()
Известно, что среднее значение суммы нескольких величин равно сумме средних значений этих величин.
![]()
Среднее значение квадратов абсолютных скоростей всех молекул одинаковое. Угол φ может принимать значения от 0 до π, поэтому среднее значение
![]()
Учитывая вышеизложенное, получим:
![]()
![]()
Средняя относительная
скорость движения одной молекулы
относительно другой в
![]() раз больше средней абсолютной скорости
молекул. С учетом этого из (4) получим
среднее число столкновений молекулы в
единицу времени:
раз больше средней абсолютной скорости
молекул. С учетом этого из (4) получим
среднее число столкновений молекулы в
единицу времени:
![]() (5)
(5)
При нормальных
условиях (p
= 1,01·105
Па, T
= 273 K)
значение
![]() из (5) составляет ~109
с-1.
из (5) составляет ~109
с-1.
Такое большое значение числа столкновений объясняет факт медленного движения молекул в определенном направлении, несмотря на то, что тепловые скорости молекул достигают сотен метров в секунду (пример: распространение запахов).
Величина обратная есть не что иное, как среднее время свободного пробега молекул:
 (6)
(6)
За время t
молекула проходит путь![]() ,
за это же время молекула делает
,
за это же время молекула делает
![]() столкновений, следовательно, средняя
длина свободного пробега молекул:
столкновений, следовательно, средняя
длина свободного пробега молекул:
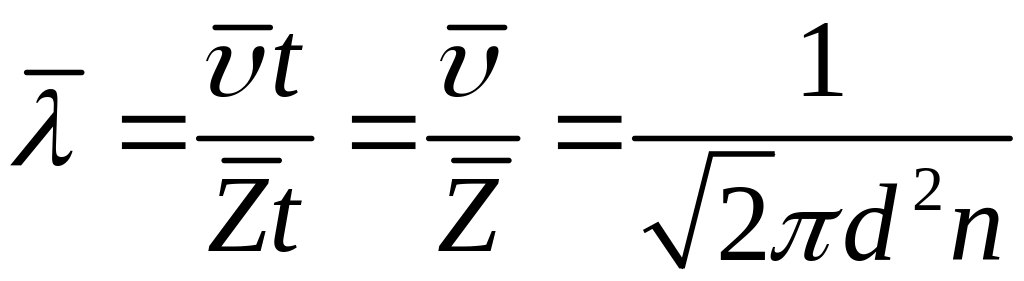 (7)
(7)
При нормальных
условиях
![]() .
.
Известно, что p = nkT. С учетом этого из (7) получим:
 (8)
(8)
Из (8) видно, что
![]() обратно пропорциональна давлению при
постоянной температуре. Из (7) следует,
что
не зависит от температуры. На самом деле
эффективный диаметр молекулы d
зависит (слабо) от температуры (от
кинетической энергии сталкивающихся
молекул). Зависимость
обратно пропорциональна давлению при
постоянной температуре. Из (7) следует,
что
не зависит от температуры. На самом деле
эффективный диаметр молекулы d
зависит (слабо) от температуры (от
кинетической энергии сталкивающихся
молекул). Зависимость
![]() выражается формулой Сезерленда:
выражается формулой Сезерленда:
 (9)
(9)
где C
– характерная для каждого газа постоянная
величина, которая имеет размерность
температуры и называется постоянной
Сезерленда.
![]() - средняя длина свободного пробега
молекулы при T→∞.
- средняя длина свободного пробега
молекулы при T→∞.
Равновесное состояние газа в МКТ всегда связано с хаотичным движением молекул, скорости которых распределены по Максвеллу. Любые неравновесные состояния газа связаны с нарушением Максвелловского распределения молекул по скоростям. Основная особенность неравновесного состояния – стремление газа самопроизвольно перейти к равновесному состоянию. Это обусловлено тепловым движением молекул и их беспрерывными столкновениями.
Установление в газе равновесного состояния с Максвелловским распределением по скоростям всегда связано с направленным переносом массы, импульса и энергии. Процессы переноса этих величин называются явлениями переноса. К явлениям переноса относятся: диффузия, внутреннее трение, теплопроводность. Диффузия обусловлена переносом массы, внутреннее трение – переносом импульса, теплопроводность – переносом энергии.
Диффузия. Диффузией называется процесс проникновения одного газа в объем другого, или движение газа из области с высокой концентрацией молекул в область, где она ниже.
Процесс диффузии заключается в том, что каждый из компонентов смеси переходит из тех мест, где его концентрация больше в те, где его концентрация меньше, это значит в направлении уменьшения концентрации.
Фик экспериментально установил, что масса вещества, переносимая через площадку dS в направлении нормали к площадке, за время dt, пропорциональна градиенту плотности в направлении переноса:
 (10)
(10)
где dM
– масса перенесенного вещества,
![]() - градиент плотности газа в направлении
x,
D
– коэффициент диффузии, который зависит
от рода газа и от условий, в которых газ
находится.
- градиент плотности газа в направлении
x,
D
– коэффициент диффузии, который зависит
от рода газа и от условий, в которых газ
находится.
Физический смысл D: коэффициент диффузии численно равен массе вещества перенесенной через единичную площадку в единицу времени, в направлении нормали к площадке, при единичном градиенте плотности.
(10) –закон Фика. Знак “-“ в правой части (10) показывает, что диффузионный поток направлен в сторону уменьшения плотности.
Рассмотрим самодиффузию газа (рис.4).
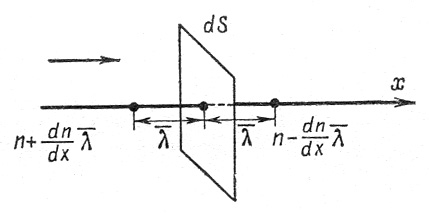
Рис.4. К расчету коэффициента диффузии.
Предположим, что концентрация молекул в том месте, где расположена площадка dS, равна n, а градиент концентрации молекул вдоль оси x – dn/dx. Тогда на расстоянии по обе стороны от площадки концентрации молекул будут соответственно равны:
 (11)
(11)
 (12)
(12)
Молекулы движутся хаотично, следовательно, все направления движения равновероятны. Тогда в направлении оси x будет двигаться 1/3 всех молекул. Из них половина, т.е. 1/6 будет двигаться слева направо, а вторая половина справа налево. Так как молекулы не сталкиваются друг с другом на пути , то за время dt через площадку dS слева на право пройдет

молекул, а в обратном направлении

молекул, где![]() .
Суммарное число молекул, которое проходит
через площадку dS
за время dt
слева направо будет равно:
.
Суммарное число молекул, которое проходит
через площадку dS
за время dt
слева направо будет равно:
 (13)
(13)
Суммарное число молекул, которое проходит через площадку dS за время dt справа налево подсчитывается аналогично:
 (14)
(14)
Разность (14) и (13) даст общее число молекул, которые проходят через площадку dS за время dt в положительном направлении оси x:
 (15)
(15)
С учетом (11) и (12) из (15) получим:
 (16)
(16)
Умножим левую и правую часть (16) на массу одной молекулы m:
 (17)
(17)
В (17) dNm = dM – масса газа, которая переносится через площадку dS за время dt, а величина:

градиент плотности, где mn = ρ – плотность газа. С учетом этого перепишем (17) в виде:
 (18)
(18)
Сравнивая (18) с законом Фика (10) получим коэффициент диффузии:
 (19)
(19)
В системе CI:

При T
= const
![]() не зависит от давления p,
а
~
1/p,
следовательно:
не зависит от давления p,
а
~
1/p,
следовательно:

Коэффициент диффузии зависит от температуры, поскольку:
 .
.
Следовательно![]() .
Опыты показывают, что при повышении
температуры D
возрастает быстрее, чем
.
Опыты показывают, что при повышении
температуры D
возрастает быстрее, чем
![]() .
Это объясняется тем, что при повышении
температуры уменьшается эффективный
диаметр молекул, что приводит к росту
(формула Сезерленда), а, значит и к
дополнительному увеличению D.
.
Это объясняется тем, что при повышении
температуры уменьшается эффективный
диаметр молекул, что приводит к росту
(формула Сезерленда), а, значит и к
дополнительному увеличению D.
