
- •Методичні вказівки до виконання лабораторних та самостійних робіт з органічної хімії
- •Лабораторна робота № 9 тема: Ароматичні вуглеводні та їх властивості
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №10 Тема: Феноли та нафтоли. Ароматичні спирти.
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №11
- •Контрольні запитання і завдання
- •Лабораторна робота № 12
- •Хід роботи
- •Лабораторна робота № 13
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота №14
- •Хід роботи:
- •Лабораторна робота №15
- •Хід роботи
- •Контрольні запитання і завдання
- •Лабораторна робота № 16
- •Контрольні запитання і завдання
- •Лабораторна робота № 17
- •Хід роботи:
- •Контрольні запитання і завдання
- •Лабораторна робота № 18
- •Хід роботи
- •Контрольні запитання і завдання
Хід роботи
ДОСЛІД 1.Бромування ароматичних вуглеводнів.
Обладнання та реактиви: бензен, толуен, нафтален, розчини брому, пробірки, штативи.
Дослід проводять у витяжній шафі. У три пробірки поміщають 1 мл бензену, 1мл толуену і 0,5-1 г нафталену. У кожну пробірку додають по 1 мл розчину брому і струшують. Потім ділять кожну суміш на дві частини. Одну частину кожної суміші з розчином брому залишають у штативі, другу частину нагрівають до кипіння і ставлять пробірку у штатив.
Ознаками реакції бромування є зникнення забарвлення брому і виділення бромистого гідрогену, що димить на повітрі.
Хімізм:
1.
FeBr3
 C6H6
+ Br2
C6H5Br
C6H6
+ Br2
C6H5Br
бензен -HBr бромбензен
4


5
повільно, а при нагріванні – дуже швидко. Нафтален поступово розчиняється і також бромується, повільно на холоду і швидше - при нагріванні. Бромування бензену не відбувається навіть при кип’ятінні.
ДОСЛІД 2: Окиснення ароматичних вуглеводнів.
Обладнання та реактиви: бензен, толуен, розчин KMnO4 (розб.), пробірки, штативи.
Досліди проводять одночасно з бензеном і толуеном. Поміщають у дві пробірки по 1 мл розчину KMnO4 і по 1 мл розбавленої H2SO4. Потім додають у одну пробірку 0,5 мл бензену, а у іншу 0,5мл толуену. Струшують пробірку декілька хвилин. Один з розчинів швидко змінює забарвлення. Забарвлення іншої суміші у цих умовах не змінюється.
Хімізм:
[О]
С 6H6
(реакція
не проходить)
6H6
(реакція
не проходить)
бензен
C 6H5 - CH3 + 3O[KMnO4] C6H5 – COOH
толуен -H2O бензойна кислота
Висновки: Бензен стійкий по відношенню до окислення і практично не реагує з перманганатом калію ні у кислому, ні у лужному середовищі. Гомологи бензену окислюються порівняно легко.
ДОСЛІД 3. Сульфування ароматичних вуглеводнів.
Обладнання та реактиви: бензен, толуен, ксилен, хімічні стакани, пробірки, штативи.
У пробірки поміщають по 0,5-1 мл (для нафталену 0,5-1 г) кожного з вуглеводнів і додають по 4 мл H2SO4 (концентр.), потім нагрівають пробірки до 80° на водяній бані при струшуванні.
6
Нафтален спочатку частково затвердіває вище рівня рідини, і його слід знову розплавити, обережно прогріваючи ці місця. Пробірки з бензеном нагрівають обережно, щоб бензен не випаровувався.
Вуглеводні при струшуванні утворюють з кислотою емульсію і поступово розчиняються ( відмічають різницю у часі для кожного вуглеводню). Після разчинення, пробірки охолоджують у стакані з водою, потім переливають вміст кожної пробірки у хімічний стакан з 10-15 мл холодної води і відмічають, чи виділяється вуглеводень або продукт реакції.
Хімізм:
Ar – H + HO – SO2OH → Ar – SO2OH
-H2O
ароматичний вуглеводень сульфокислота
Висновки: Найбільш швидко (5-10 хвилин) сульфується і переходить у розчин ксилен, повільніше – толуен і нафтален і найбільш повільно – бензен. Сульфогрупи вступають у молекули толуену і ксилену переважно в орто- і пара- положенні по відношенню до СН3- групи; у молекулу нафталену винятково у положення 1 (α). Сульфокислоти являються сильними кислотами і добре розчинні у воді, як і їх солі з лужними металами.
ДОСЛІД 4.Отримання нітробензолу.
Обладнання та реактиви: бензен, H2SO4 (концентр.), хімічні стакани, пробірки, штативи.
Готується нітруючу суміш змішуючи у широкій пробірці 1,5 мл HNO3 (конц.) і 2 мл H2SO4 (конц.). Суміш охолоджують у воді. В отриману суміш додають по краплям 1 мл бензену при струшуванні та охолодженні у воді.
Через 3-5 хвилин суміш виливають у хімічний стакан з 20-30 мл води, струшують і відстоюють. Нітробензен виділяється у вигляді важкої
7
жовтуватої олії.
Хімізм:
H
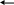 ONO2
+ H2SO4
H2O
+ HOSO2ONO2
H2O
+ HOSO2O
-
+ NO +
ONO2
+ H2SO4
H2O
+ HOSO2ONO2
H2O
+ HOSO2O
-
+ NO +
H2SO4
C6H6 + HO – NO2 C6H5 – NO2 + H2O
бензен нітробензен
Висновки: Для ароматичних вуглеводнів характерна властивість при взаємодії з нітратною кислотою перетворюватись у нітросполуки. Для полегшення нітрування використовують нітруючу суміш , що містить катіон нітронію (NO2+). Він являється електрофільним нітруючим реагентом. При введенні нітро-групи у молекулу ароматичної сполуки щільність отриманої сполуки підвищується по відношенню до початкової сполуки. Нітропохідні ароматичних вуглеводнів нерозчинні у воді деякі мають жовте забарвлення.
