
- •Теплотехика. Лекция 1.Основные понятия термодинамики. Смеси газов. Теплоёмкость. Термодинамика и тепломассообмен
- •1.Основные понятия и определения
- •1.1.Рабочие тела, их свойства и характеристики.
- •1.2.Молекулярно-кинетическая теория газов
- •1.3. Универсальное уравнение состояния идеального газа
- •1.4. Смесь идеальных газов
- •Задачи тестов
- •1.5. Теплоемкость газа
- •Вопросы тестов Теплоемкость
- •Задачи тестов
Задачи тестов
1.Смесь идеальных газов состоит из двух компонентов. Их парциальные давления равны р1 = 1000 Па, р2 = 100 Па. Полное давление составляет ___ кПа.
2.Объемные доли водорода и аргона rH2 = 10 %, rO2 = 2 %. Массовая доля водорода равна _____%.
Решение:
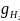 =
=
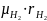 /(
+
/(
+
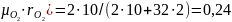 .
??!!
.
??!!
Задача. Объемный состав сухих продуктов сгорания топлива (не содержащих водяных паров) следующий: 12,3% СО2, 7,2% О2, 80,5% N2.
Найти кажущуюся молекулярную массу смеси и газовую постоянную, а также плотность и удельный объем продуктов сгорания при давлении 100 кПа и температуре 800 ˚С.
Дано:
rCO2
= 0,123; μCO2
= 44
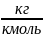 ,
rO2
= 0,072; μО2
= 32
,
rN2
= 0,805; μN2
= 28 к
P
=
100 кПа = 105
Па, t
=
800 ˚С. Найти: μсм,
Rсм,
ρcм,
νсм
,
rO2
= 0,072; μО2
= 32
,
rN2
= 0,805; μN2
= 28 к
P
=
100 кПа = 105
Па, t
=
800 ˚С. Найти: μсм,
Rсм,
ρcм,
νсм
Решение: Кажущуюся молекулярную массу определяем из уравнения (1.19)
μсм = Σ r μ = rСО2·μСО2 + rO2·μO2 + rN2·μN2 = 0,123⋅44 + 0,072⋅32 + 0,805⋅28 = 30,3 .
Газовую
постоянную – из уравнения (1.17): Rcм
=
 =
=
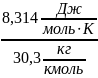 = 274
= 274
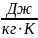 .
.
Удельный объем находим из уравнения состояния идеального газа (1.8)
νсм
=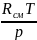 =
=
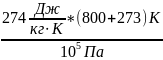 =
2,94
=
2,94
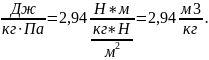
Находим
плотность ρсм
=
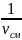 =
=
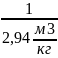 =
0,34
=
0,34
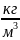 .
.
1.5. Теплоемкость газа
Теплоёмкостью тела называется количество теплоты, необходимое для изменения его температуры на 1 К.
Истинная теплоемкость рабочего тела определяется отношением количества подведенной (отведенной) к рабочему телу теплоты в данном термодинамическом процессе к вызванному этим изменениям температуры тела:
C
=
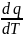
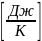 (1.25)
(1.25)
Для практических расчетов удобно пользоваться средними теплоемкостями, значения которых даются в справочных таблицах или подсчитываются по эмпирическим формулам.
Средняя теплоемкость относится к интервалу температур, а истинная к конкретной температуре.
Г еометрически
средняя теплоемкость
представляет собой высоту прямоугольника
1’342', площадь которого
равна площади 1’122' под кривой с(Т)
(рис.1). Каждая из этих площадей численно
равна удельной теплоте, подведенной к
рабочему
телу в интервале температур Т1
–Т2:
еометрически
средняя теплоемкость
представляет собой высоту прямоугольника
1’342', площадь которого
равна площади 1’122' под кривой с(Т)
(рис.1). Каждая из этих площадей численно
равна удельной теплоте, подведенной к
рабочему
телу в интервале температур Т1
–Т2:
q
=
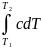 = ccp
= ccp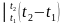 .
(1.26)
.
(1.26)
При пользовании такими теплоемкостями, удельную теплоту подсчитывают по выражению
c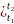 =
=
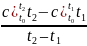
Теплоемкость зависит от внешних условий или характера процесса, при котором происходит подвод или отвод теплоты.
Рис.1. Средняя теплоемкость .
в интервале температур Т1-Т2 /
Различают следующие удельные теплоемкости:
массовую: c
=
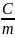 ;
;
молярную: μc
=
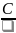
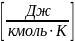 ,
где
,
где
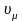 – количества вещества [кмоль];
– количества вещества [кмоль];
объемную:, c =
=
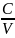
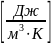 .
.
Связь между этими
теплоемкостями:
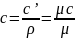
где
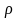 – плотность вещества,
– плотность вещества,
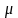 – молярная (молекулярная) масса,
[кг/кмоль].
– молярная (молекулярная) масса,
[кг/кмоль].
Теплоемкость газов в большой степени зависит от тех условий, при которых происходит процесс их нагревания или охлаждения. Различают теплоемкости при постоянном давлении (изобарную) и при постоянном объеме (изохорную):
ср, сv – массовые изобарные и изохорные теплоемкости;
μср , μсv – молярные изобарные и изохорные теплоемкости;
ср´ , сv´ –объемные изобарные и изохорные теплоемкости.
Связь между изобарной и изохорной теплоемкостями дается уравнением Майера
ср - сv = Rµ (1.27)
μср -μсv = R0 (1.28)
В процессе v=const теплота, сообщаемая газу, идет лишь на изменение его внутренней энергии, тогда как в процессе p=const теплота расходуется и на увеличение внутренней энергии и на совершение работы против внешних сил.
Поэтому ср больше сv на величину этой работы. Следовательно, газовая постоянная Rµ численно равна работе расширения одного килограмма газа при на-гревании его при постоянном давлении на один градус.
Для реальных газов ср - сv > Rµ, поскольку при расширении реальных газов (при p=const) совершается работа не только против внешних сил, но и против сил притяжения, действующих между молекулами, что вызывает дополнительный расход теплоты.
Удельные массовые изохорная сv и изобарная сp теплоемкости определяются по соотношениям молекулярно-кинетической теории:
сv=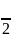 Rµ,
сp=сv+
Rµ=
Rµ,
сp=сv+
Rµ=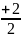 Rµ,
(1.29)
Rµ,
(1.29)
где i - число степеней свободы молекулы идеального газа (для одноатомного газа i=3, двухатомного - i=5, трехатомного и более - i=6).
Для молярных теплоемкостей это даёт:
для одноатомных rазов:
µсv
= 12,48
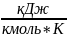 ;
µср
= 20,8
;
;
µср
= 20,8
;
для двухатомных rазов: µсv = 20,8 ; µср = 29,12 .
Из
(1.29) следует, что показатель адиабаты
k
=
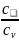 =
=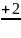 .
Тогда для одноатомных rазов k
=1,67,
для двухатомных
k
=1,40,
для трехатомных и более k
=1,33.
.
Тогда для одноатомных rазов k
=1,67,
для двухатомных
k
=1,40,
для трехатомных и более k
=1,33.
