
- •428015 Чебоксары, Московский просп.15
- •Лабораторная работа №2. Исследование статистических закономерностей биномиального распределения методом моделирования на эвм.
- •II. Лабораторная работа № 4. Измерение теплоемкости металлов и параметров естественной конвекции методом охлаждения.
- •III. Лабораторная работа № 5. Определение отношения теплоемкостей ср/сv газов методом адиабатического расширения.
- •IV. Лабораторная работа №6. Определение отношения удельных теплоемкостей газов по скорости звука в.
- •V. Лабораторная работа № 7. Определение коэффициента теплопроводности воздуха.
- •VI. Лабораторная работа № 10. Определение коэффициента внутреннего трения воздуха капиллярным вискозиметром.
- •VII. Лабораторная работа № 12. Определение коэффициента внутреннего трения жидкости по методу стокса.
- •1. Понятие о вязкости.
- •2. Зависимость вязкости жидкостей и газов от параметров состояния.
- •3. Молекулярно–кинетические представления о механизме явлений переноса в жидкостях.
- •4.Экспериментальное определение энергии активации скачков молекул.
- •VIII. Лабораторная работа № 21. Построение диаграммы состояния системы вода - фенол.
- •IX. Лабораторная работа №23. Определение теплоты испарения жидкости по зависимости давления насыщенного пара от температуры.
- •1. Испарение жидкости. Теплота испарения. Насыщенный пар.
- •2. Уравнение Клапейрона – Клаузиуса. Зависимость давления насыщенного пара жидкости от температуры.
- •4. Кипение жидкости. Перегретая жидкость.
- •Приложение 1.
- •Приложение 2.
- •Приложение 3.
III. Лабораторная работа № 5. Определение отношения теплоемкостей ср/сv газов методом адиабатического расширения.
1. ТЕОРИЯ МЕТОДА.
Отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме: =СР / CV является важной характеристикой газов. Для идеального газа это отношение связано с эффективным числом iэф степеней свободы молекул газа:
= (iэф +2) / iэф (III.1).
Описываемый ниже способ определения этого отношения достаточно прост.
Пусть мы имеем стеклянный сосуд, содержащий исследуемый газ. Сосуд соединен с жидкостным (водяным) манометром, а посредством крана может соединяться с атмосферой. Если накачать в сосуд небольшое дополнительное количество газа, то давление в сосуде повысится. При быстром сжатии газа температура его так же повысится. Окончательное давление газа Р1 в сосуде установится, когда его температура сравняется благодаря теплопроводности стенок с температурой окружающего воздуха Т0. Это состояние (Т0 , Р1) назовем первым состоянием газа.
Давление р1 можно выразить через разность уровней жидкости h1 в манометре:
Р1 = Р0 + k h1, (III.2).
где Р0 - атмосферное давление, k – размерный коэффициент.
Если теперь быстро открыть кран, то газ из сосуда будет выходить в атмосферу и адиабатически расширяться, пока давление его в сосуде не сделается равным Р0. При этом он охладится до температуры Т2; это будет вторым состоянием газа (состояние Т2, Р0).
Если сразу после открывания снова закрыть кран, то давление внутри сосуда начнет возрастать вследствие того, что охладившийся при расширении газ станет снова нагреваться. Возрастание давления прекратиться, когда температура газа в сосуде сравняется с внешней температурой Т0; это будет третьим состоянием газа (состояние Т0, Р2).
Давление р2 так же можно выразить через разность уровней жидкости h2 в манометре:
Р2 = Р0 + k h 2 (III.3).
Так как переход от состояния 2 к состоянию 3 произошел без изменения объема, то мы вправе применить здесь закон Гей-Люссака
![]() (III.4).
(III.4).
К адиабатическому процессу перехода из состояния 1 в состояние 2, может быть применен закон Пуассона, который удобно написать в следующей форме:
 . (III.5).
. (III.5).
Подставляя сюда значения Р1 из уравнения (III.2) и переставляя члены, получим

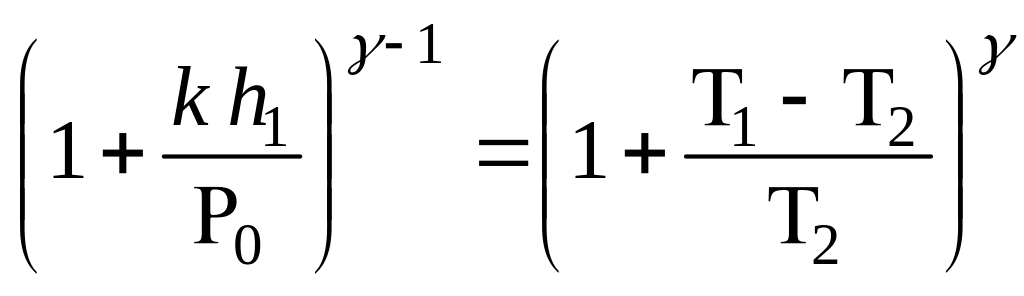 .
.
Так как k h1 /P0 и (Т1-Т2) /Т2 — величины малые по сравнению с единицей, то, разлагая оба двучлена в ряд Тейлора и ограничиваясь членами первого порядка малости, получим приближенную формулу:
![]() .
.
Подставив в уравнение (III.4) значение Р2 из уравнения (III.3), получим
![]() ,
, ![]() .
.
Окончательно
находим:
 (III.6)
(III.6)
2. ОПИСАНИЕ ПРИБОРА.
Прибор (рис.2) состоит из стеклянного баллона, соединенного шлангами с манометром М и насосом Н. Через кран К баллон может сообщаться с атмосферой. Из-за того, что сжатый газ из баллона через кран К выходит в течение определенного промежутка времени, не равного нулю, процесс расширения газа от 1-го состояния ко 2-му нельзя считать строго адиабатическим. При этом ошибка будет тем меньше, чем меньше времени кран К находится в открытом положении. Разумеется, это время должно быть достаточно для выравниваний давлений внутри и вне баллона. Для избежания указанной ошибки рекомендуется повторить опыт несколько раз, меняя время выдержки t клапана в открытом положении, и графически экстраполировать полученные отношения к промежутку времени t = 0.
Наиболее удобными для экстраполяционного графика являются координаты ln (h2 / h1 ) = f (t), в которых график имеет вид почти прямой линии.
Н
М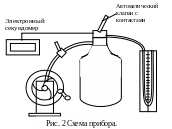

3. ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ.
Закрыть кран К и насосом Н накачать в баллон воздух до давления на 300 мм водяного столба выше атмосферного давления.
Выждать 1-2 минуты, пока давление установиться, измерить начальную разность уровней жидкости h1 в манометре и занести в таблицу
Открыть кран на требуемый промежуток времени t. Рекомендуемые значения t, с: 2.5, 3, 4, 5, 7, 10, 15. Фактическое значение t измерить по электронному секундомеру и занести в таблицу
Выждать 1-2 минуты, пока давление перестанет меняться, измерить конечную разность уровней жидкости h2 в манометре и занести в таблицу.
Опыт повторить 7 раз, каждый раз устанавливая одинаковое начальное давление (с точностью 10 мм водяного столба) и увеличивая время выдержки t крана в открытом положении.
По полученным данным нанести точки графика зависимости ln (h2 / h1 )=f(t). На графике провести прямую, лучше всего соответствующую всей совокупности точек, Для этой прямой определить отношение h2 / h1, которое соответствует t=0.
Для сравнения рассчитать отношение h2 / h1 на компьютере, выполнив по методу наименьших квадратов линейную аппроксимацию полученной зависимости ln (h2 / h1 ) от t.
Полученное значение h2 / h1 подставить в формулу (III.6) и рассчитать значение
 .
.По значению из формулы (III.1) определить среднее эффективное число степеней свободы iэф молекул воздуха.
Полученные значения и iэф сравнить с теоретическими значениями для двухатомных газов. Сформулировать выводы.
Рекомендуемая форма таблицы результатов измерений
№ |
h 1, мм |
t, с |
h 2, мм |
h2 / h1 |
Ln(h2 / h1 ) |
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
7 |
|
|
|
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ .
1. Теплоемкость. Виды теплоемкости. Соотношения между ними.
2. Распределение энергии по степеням свободы молекул газа. Особенности этого распределения при разных температурах.
3. Стандартные процессы в газах; их уравнения и графики в различных координатах.
4. Из (III.2) - (III.5) получить точную формулу для .
ЛИТЕРАТУРА.
А. Н. Матвеев ‘‘Молекулярная физика ’’ М.,1987 г. §§ 10, 12, 19, 22, 23.
