
Пиролиз углеводородов Введение
Цель работы: Изучение основных закономерностей протекания химико технологического процесса на примере сложной гомогенной, обратимой, гомогенной реакции – пиролиза жидких нефтепродуктов.
Пиролиз (высокотемпературный крекинг) - термическое разложение органических соединений протекающее при температурах более 700 С, при пониженных давлениях с целью получения низших альфа олефинов.
До настоящего времени пиролиз остаётся основным способом получения низших олефинов — этилена и пропилена. Существующие мощности установок пиролиза составляют 113,0 млн.т/год по этилену или почти 100 % мирового производства и 38,6 млн.т/год по пропилену или более 67 % мирового производства (остальное — 30 % производства пропилена приходится на каталитический крекинг, около 3 % мирового производства пропилена вырабатывается из нефтезаводских газов НПЗ, а именно из газов процессов замедленного коксования и висбрекинга). При этом, среднегодовой прирост потребления этилена и пропилена в мире составляет более 4 %.
Среди указанных мономеров первое место по масштабам потребления занимают этилен и пропилен.
Связи между производством олефинов и областями их потребления показаны на схеме:
→ полиэтилен
→ этилбензол → стирол → полистирол
→ окись этилена → этиленгликоль → полиэфирное волокно
Этилен → дихлорэтан → винилхлорид → поливинилхлорид
→ этиловый спирт → ацетальдегид → уксусная кислота
→ винил (волокно)
→ пропиловый спирт
→ сополимер с пропиленом
→ полипропилен
→ окись пропилена → пропиленгликоль
→ акрилонитрил→ полиарилаты
→ глицерин→ полиглицерин
Пропилен → изопропилбензол → фенол, ацетон, бисфенол А, поликарбонатное стекло
→ н-бутиловый спирт
→ изодециловый спирт
→ изопрен → изопреновый каучук
Наряду с производством этилена и пропилена, процесс пиролиза является основным источником дивинила, который выделяют из сопутствующей пиролизной фракции С4 и бензола, получаемого из жидких продуктов пиролиза. Около 80 % мирового производства дивинила и 39 % бензола приходится на производство пиролиза.
Условия проведения процесса
В промышленных условиях пиролиз осуществляют при температурах 800—900°С и при давлениях, близких к атмосферному (на входе в пирозмеевика ~ 0,3 МПа, на выходе — 0,1 МПа). Время пребывания сырья в зоне реакции составляет 0,1 — 0,5 сек.
Условно все реакции при пиролизе можно разделить на первичные и вторичные.
Основные характеристики первичных реакции:
- первичных реакции протекают с увеличением объёма;
- в основном протекают с поглощением тепла (то есть эндотермичны)
В основном это реакции расщепления парафинов и нафтеновых углеводородов с разрывом по углерод – углеродной связи с образованием углеводородов с меньшей молекулярной массой.
![]()
Дегидрирование предельных и нафтеновых углеводородов
![]()
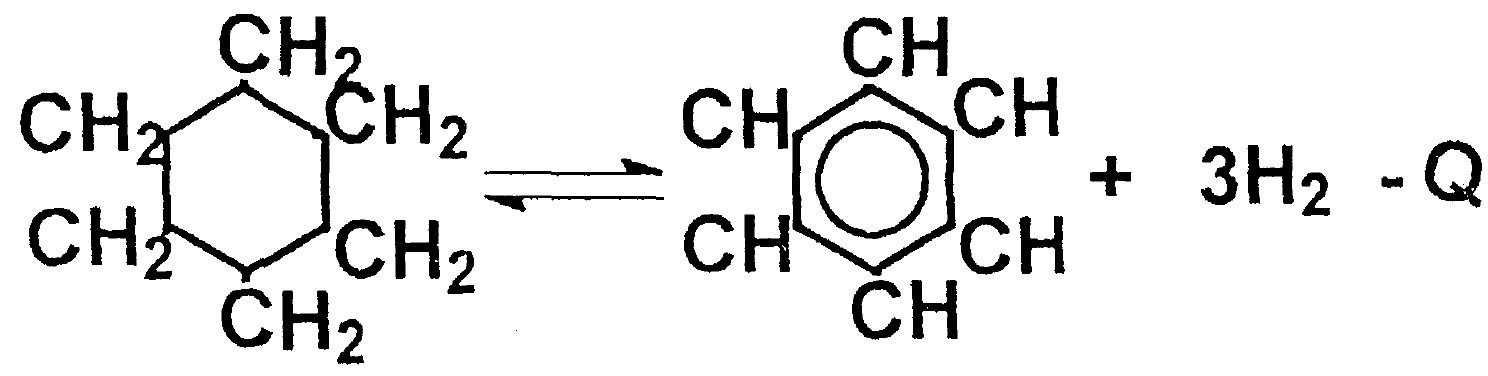
Деалкилирование ароматических углеводородов с отрывом алкильного радикала
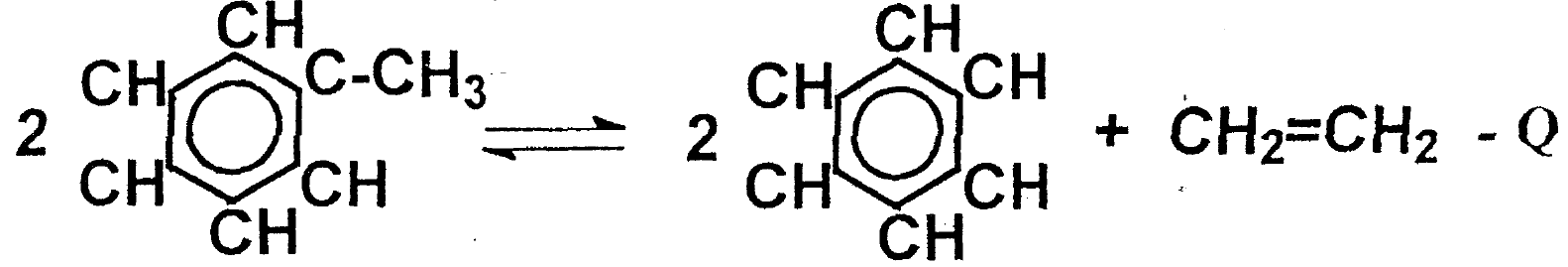
Изомеризация предельных углеводородов (экзо реакция)
![]()
Вторичные реакции протекают, преимущественно, на поздних стадиях пиролиза в подавляющем большинстве случаев протекают с выделением тепла и с уменьшением объёма реакционной смеси.
Полимеризация

Циклизация олефинов
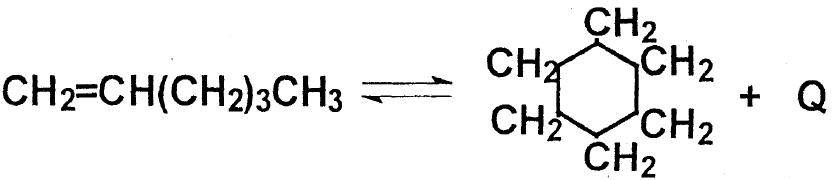

Конденсация диолефинов с олефинами

Дегидрирование олефинов с образованием диолефинов
![]()
Также к вторичным реакциям можно отнести реакции образования различных твёрдых углеродистых соединений, которые в промышленности принято называть коксом. Однако, ещё раз следует подчеркнуть, что такое деление реакций на первичные и вторичные условно.
Для снижения скоростей вторичных реакций пиролиза используют разбавление сырья пиролиза водяным паром. В результате парциальное давление углеводородов снижается и, согласно принципу Ле-Шателье, снижение давления в зоне реакции будет способствовать протеканию реакций, идущих с увеличением объёма, то есть — первичных. Для этана, бутана, прямогонного бензина соотношение пара к сырью обычно составляет 0,3 : 1,0, 0,4 : 1,0, 0,5 : 1,0 соответственно.
