
- •1. Общая химия
- •1.1. Атомно-молекулярное учение. Основные понятия и законы химии
- •Закон сохранения массы веществ
- •Закон постоянства состава веществ
- •Закон эквивалентов
- •Закон эквивалентов
- •6 Ионам соответствует 1 фе Al2(so4)3,
- •1 Иону соответствует х фе Al2(so4)3,
- •Закон Авогадро
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы.
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объемам данных газов, участвующих в этих реакциях.
- •Закон Бойля – Мариотта
- •Пример 1.1.12. При некоторой температуре и давлении 98,5 кПа объем газа равен 10,4 дм3. Вычислите объем данной порции газа при той же температуре и давлении 162,6 кПа.
- •Закон Шарля – Гей-Люссака
- •Объединенный газовый закон
- •Закон парциальных давлений газов (закон Дальтона)
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.2. Основные классы неорганических соединений
- •Бинарные соединения
- •Многоэлементные соединения
- •Задачи и упражнения
- •1.3. Энергетика химических реакций
- •Возможность и условия протекания реакции при различных сочетаниях знаков rH и rS
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.4. Основы химической кинетики. Химическое равновесие Факторы, влияющие на скорость химической реакции
- •Влияние температуры на скорость химической реакции
- •Химическое равновесие
- •Влияние изменения внешних условий на положение химического равновесия. Принцип Ле Шателье
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.5. Количественный состав растворов
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.6. Равновесия в растворах электролитов
- •Константа воды (ионное произведение воды). Водородный показатель
- •Константа растворимости (произведение растворимости)
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Константа гидролиза соли Kh
- •Связь между степенью и константой гидролиза соли
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.7. Строение атома и периодический закон д. И. Менделеева Вопросы для самостоятельной подготовки
- •1.8. Химическая связь и межмолекулярное взаимодействие Вопросы для самостоятельной подготовки
- •1.9. Окислительно-восстановительные реакции
- •Важнейшие восстановители
- •Важнейшие окислители:
- •Овр межмолекулярного типа
- •Овр внутримолекулярного типа
- •Расстановка коэффициентов в уравнениях овр методом электронного баланса
- •Электродные и окислительно-восстановительные потенциалы и их использование
- •Влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •Влияние концентраций потенциалопределяющих ионов
- •Влияние величины рН раствора
- •Влияние температуры на направление протекания овр
- •Влияние величины пр малорастворимого продукта на направление протекания овр
- •Влияние комплексообразования на направление протекания овр
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.10. Комплексные соединения
- •Cтроение и состав комплексных соединений
- •Классификация комплексных соединений
- •Номенклатура комплексных соединений Названия комплексообразователей
- •Названия лигандов
- •Названия комплексных соединений
- •Диссоциация комплексных соединений в водных растворах
- •Реакции с участием комплексных ионов Реакции ионного обмена
- •Реакции лигандного обмена
- •Реакции связывания лигандов
- •Реакции осаждения комплексообразователей
- •Реакции полного восстановления комплексообразователей
- •Химическая связь в комплексных соединениях. Геометрическая форма комплексных частиц
- •Важнейшие типы гибридизации орбиталей и соответствующие им геометрические конфигурации комплексных частиц
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •2. Неорганическая химия
- •2.1. Примерная схема описания группы элементов, их атомов и образованных ими простых и сложных веществ
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •2.8. Общая характеристика d-элементов Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Приложения
- •1. Стандартные энтальпии образования и стандартные энтропии некоторых веществ при 298 k
- •2. Константы диссоциации некоторых слабых электролитов в водных растворах при 25 оС
- •3. Произведения растворимости некоторых малорастворимых электролитов при 25 оС
- •4. Константы нестойкости некоторых комплексных ионов при 25 оС
- •5. Стандартные электродные потенциалы Еo в водных растворах при 25 оС
- •Литература
- •Оглавление
Закон парциальных давлений газов (закон Дальтона)
Общее давление смеси газов, не вступающих в химическое взаимодействие, равно сумме парциальных давлений каждого из указанных газов.
Математическое выражение закона:
p(cм.) = p(1) + p(2) + ... + p(n),
где p(cм.) – общее давление газовой смеси; p(1), p(2), p(n) – парциальные давления каждого из газов смеси.
Парциальное давление газа (от латинского «pars» – часть) – давление, которое оказывал бы данный газ на стенки сосуда, если бы он один занимал весь объем газовой смеси при тех же условиях.
При решении задач с использованием данного закона необходимо помнить, что парциальное давление данного газа прямо пропорционально его объемной (φ) или мольной (χ) доле в газовой смеси:
p(1)= φ(1) · p(смеси) = χ(1) · p(смеси).
Пример 1.1.16. Общее давление смеси, состоящей из азота массой 14 г и кислорода массой 8 г, равно 155 кПа. Вычислите значения парциальных давлений газов в смеси.
Решение.
Поскольку в смеси объемные доли газов численно равны их мольным долям, то в данном случае парциальные давления газов будут пропорциональны их мольным долям.
1) Рассчитаем химическое количество каждого из газов:
![]() n(N2)
=
n(N2)
= = 0,5 моль;
= 0,5 моль;
n(O2)
=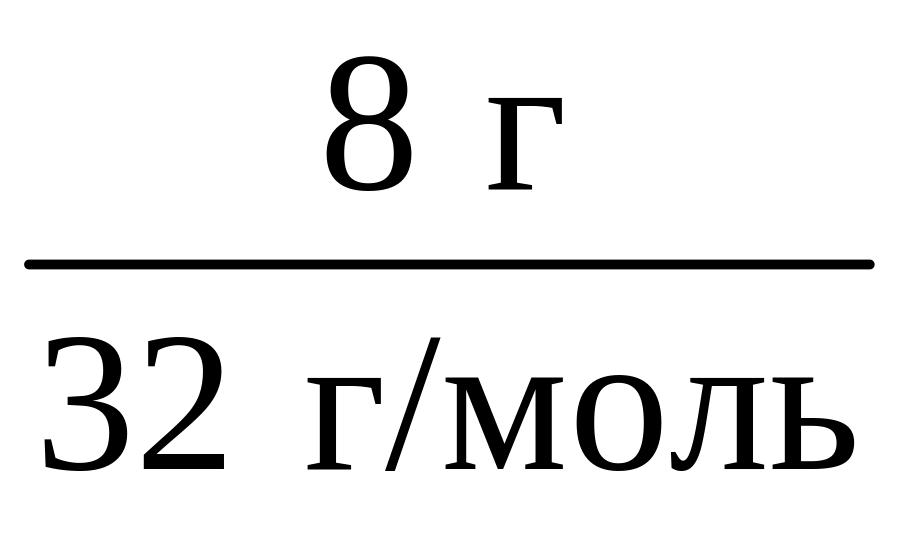 = 0,25 моль.
= 0,25 моль.
2) Рассчитаем значения мольных долей газов в смеси:
χ(N2)
=
Следовательно, мольная доля кислорода χ(О2) равна:
χ(O2) = 1 – 0,666 = 0,334.
3) Рассчитаем значения парциальных давлений газов:
p(N2) = χ(N2) ∙ р(смеси) = 0,666 · 155 кПа = 103,23 кПа;
p(O2) = χ(O2) ∙ р(смеси) = 0,334 · 155 кПа = 51,77 кПа.
Пример 1.1.17. В сосуде объемом 6 дм3 смешали кислород объемом 3,5 дм3, находившийся под давлением 125 кПа, и азот объемом 5,5 дм3, находившийся под под давлением 105 кПа. Вычислите парциальные давления газов и общее давление полученной смеси.
Решение.
1) По уравнению Бойля – Мариотта рассчитаем новые давления газов в полученной смеси (т. е. их парциальные давления):
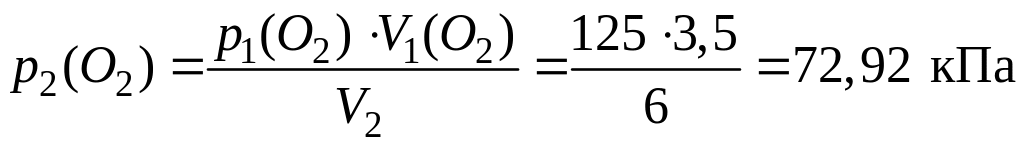 ;
;
 .
.
2) Найдем общее давление смеси:
р(смеси) = p2(О2) + p2(N2) = 72,92 кПа + 96,25 кПа = 169,17 кПа.
Пример 1.1.18. В баллоне объемом 44,5 дм3 при температуре 19 oС содержатся кислород массой 27,2 г, углекислый газ массой 55,0 г и азот неизвестной массы. Вычислите массу азота в смеси, если ее давление равно 139,05 кПа.
Решение.
1) Из уравнения Клапейрона – Менделеева выразим давление и рассчитаем его значения для кислорода и углекислого газа:
![]() ;
;
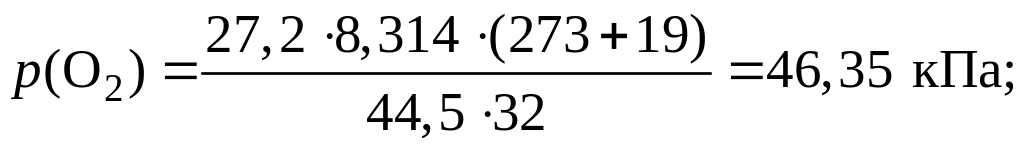
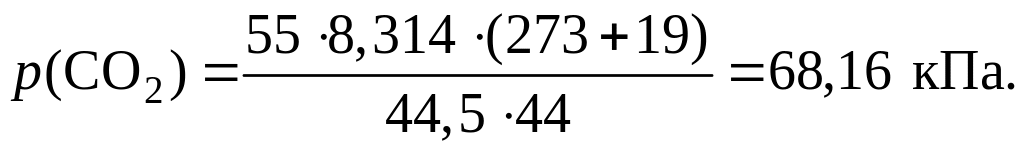
2) Рассчитаем парциальное давление азота в смеси:
p(N2) = р(смеси) – p(CO2) – p(O2) = 139,05 – 68,16 – 46,35 = 24,5 кПа.
3) Рассчитаем значение массы азота в смеси:
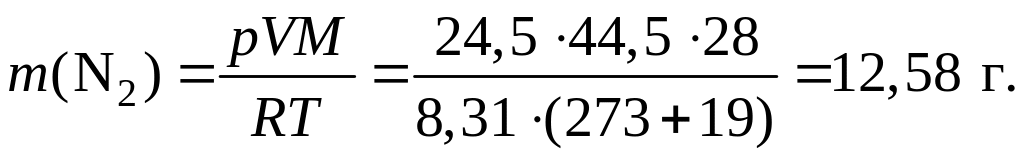
Пример 1.1.19. В газометре над водой при температуре 25 оС содержится кислород объемом 5,2 дм3 под давлением 102,455 кПа. Рассчитайте объем сухого кислорода в газометре при н. у., если давление насыщенного водяного пара при 25 oС равно 3,164 кПа.
Решение.
1) Рассчитаем парциальное давление чистого кислорода в его смеси с водяным паром:
р(O2) = р(cмеси) – p(H2O) = 102,455 – 3,164 = 99,291 кПа.
2) Из уравнения Клапейрона выразим V0 и рассчитаем его:

Вопросы для самостоятельной подготовки
1. Сформулируйте определения понятий: атом, химический элемент, молекула, радикал, ион, вещество.
2. Чем атомные частицы отличаются от молекулярных частиц?
3. Cколько химических элементов известно в настоящее время? В чем заключаются различия между химическим элементом и простым веществом? Какие характеристики присущи элементу, а какие – простому веществу?
4. Что такое постоянная атомной массы? Чему она равна и как обозначается?
5. Что характеризуют относительная атомная и относительная молекулярная массы? Почему эти величины являются безразмерными?
6. Почему число простых веществ (~ 550) гораздо больше числа известных химических элементов? Чем обусловлено явление аллотропии?
7. Приведите примеры веществ молекулярного и немолекулярного (атомного, ионного) строения. Какие физические свойства присущи тем и другим веществам?
8. Дайте определение понятия «формульная единица вещества». Приведите примеры ФЕ веществ молекулярного и немолекулярного строения.
9. Чем простейшие (эмпирические) формулы веществ отличаются от молекулярных формул? Как они связаны между собой? Приведите примеры.
10. Чем определяется химическое количество вещества? Сформулируйте определение понятия моль. Каков физический смысл постоянной Авогадро и чему равно ее значение?
11. Что представляет собой молярная масса вещества? Как она связана с массой вещества и его химическим количеством? Какие значения принимает молярная масса и в каких единицах она выражается?
12. Что такое молярный объем газа? Как он связан с объемом газа и его химическим количеством? Почему у разных газов при одинаковых условиях значение молярного объема примерно одинаково?
13. Сформулируйте закон сохранения массы веществ. Как можно интерпретировать этот закон с точки зрения атомно-молекулярного учения?
14. Сформулируйте закон постоянства состава веществ. К каким соединениям он применим и почему? Какие вещества относятся к веществам постоянного, а какие – к веществам переменного состава? Приведите примеры.
15. Что обозначает формула Сr0,87S? Можно ли ее записать в виде СrS1,15? Почему?
16. Сформулируйте закон эквивалентов. Дайте определения понятиям эквивалент, число эквивалентности, фактор эквивалентности, молярная масса эквивалентов, молярный объем эквивалентов.
17. Почему эквивалентами одного и того же вещества могут быть разные частицы? Поясните на конкретных примерах.
18. Почему молярная масса эквивалентов одного и того же вещества может иметь разные значения?
19. Сформулируйте закон Авогадро. К веществам в каком агрегатном состоянии он применим и почему?
20. Сформулируйте важнейшие следствия из закона Авогадро. Какие условия считаются нормальными и чему равен молярный объем газа при этих условиях? В каких единицах он выражается?
21. Что характеризует относительная плотность одного газа по другому газу?
22. Как рассчитывается плотность газа и каков ее физический смысл?
23. Что характеризует средняя молярная масса газовой смеси? Как она рассчитывается? Чему равна средняя молярная масса воздуха?
24. Сформулируйте законы Бойля – Мариотта и Шарля – Гей-Люссака, запишите их математические выражения.
25. Сформулируйте объединенный газовый закон и запишите его математическое выражение. В каких расчетах он используется?
26. Запишите уравнение Клапейрона – Менделеева. Каков физический смысл молярной газовой постоянной? Какие значения она может принимать и от чего зависит ее величина?
27. Какое давление называется парциальным давлением газа? Как оно связано с общим давлением газовой смеси? Сформулируйте закон парциальных давлений газов.
