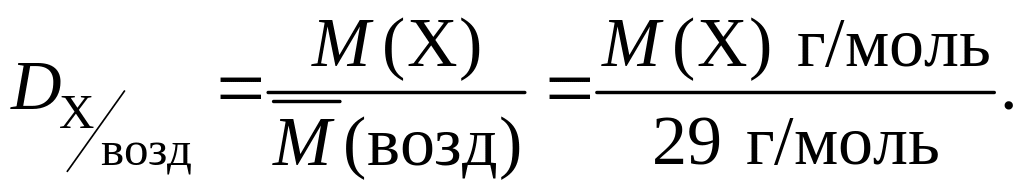- •1. Общая химия
- •1.1. Атомно-молекулярное учение. Основные понятия и законы химии
- •Закон сохранения массы веществ
- •Закон постоянства состава веществ
- •Закон эквивалентов
- •Закон эквивалентов
- •6 Ионам соответствует 1 фе Al2(so4)3,
- •1 Иону соответствует х фе Al2(so4)3,
- •Закон Авогадро
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы.
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объемам данных газов, участвующих в этих реакциях.
- •Закон Бойля – Мариотта
- •Пример 1.1.12. При некоторой температуре и давлении 98,5 кПа объем газа равен 10,4 дм3. Вычислите объем данной порции газа при той же температуре и давлении 162,6 кПа.
- •Закон Шарля – Гей-Люссака
- •Объединенный газовый закон
- •Закон парциальных давлений газов (закон Дальтона)
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.2. Основные классы неорганических соединений
- •Бинарные соединения
- •Многоэлементные соединения
- •Задачи и упражнения
- •1.3. Энергетика химических реакций
- •Возможность и условия протекания реакции при различных сочетаниях знаков rH и rS
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.4. Основы химической кинетики. Химическое равновесие Факторы, влияющие на скорость химической реакции
- •Влияние температуры на скорость химической реакции
- •Химическое равновесие
- •Влияние изменения внешних условий на положение химического равновесия. Принцип Ле Шателье
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.5. Количественный состав растворов
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.6. Равновесия в растворах электролитов
- •Константа воды (ионное произведение воды). Водородный показатель
- •Константа растворимости (произведение растворимости)
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Константа гидролиза соли Kh
- •Связь между степенью и константой гидролиза соли
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.7. Строение атома и периодический закон д. И. Менделеева Вопросы для самостоятельной подготовки
- •1.8. Химическая связь и межмолекулярное взаимодействие Вопросы для самостоятельной подготовки
- •1.9. Окислительно-восстановительные реакции
- •Важнейшие восстановители
- •Важнейшие окислители:
- •Овр межмолекулярного типа
- •Овр внутримолекулярного типа
- •Расстановка коэффициентов в уравнениях овр методом электронного баланса
- •Электродные и окислительно-восстановительные потенциалы и их использование
- •Влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •Влияние концентраций потенциалопределяющих ионов
- •Влияние величины рН раствора
- •Влияние температуры на направление протекания овр
- •Влияние величины пр малорастворимого продукта на направление протекания овр
- •Влияние комплексообразования на направление протекания овр
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.10. Комплексные соединения
- •Cтроение и состав комплексных соединений
- •Классификация комплексных соединений
- •Номенклатура комплексных соединений Названия комплексообразователей
- •Названия лигандов
- •Названия комплексных соединений
- •Диссоциация комплексных соединений в водных растворах
- •Реакции с участием комплексных ионов Реакции ионного обмена
- •Реакции лигандного обмена
- •Реакции связывания лигандов
- •Реакции осаждения комплексообразователей
- •Реакции полного восстановления комплексообразователей
- •Химическая связь в комплексных соединениях. Геометрическая форма комплексных частиц
- •Важнейшие типы гибридизации орбиталей и соответствующие им геометрические конфигурации комплексных частиц
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •2. Неорганическая химия
- •2.1. Примерная схема описания группы элементов, их атомов и образованных ими простых и сложных веществ
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •2.8. Общая характеристика d-элементов Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Приложения
- •1. Стандартные энтальпии образования и стандартные энтропии некоторых веществ при 298 k
- •2. Константы диссоциации некоторых слабых электролитов в водных растворах при 25 оС
- •3. Произведения растворимости некоторых малорастворимых электролитов при 25 оС
- •4. Константы нестойкости некоторых комплексных ионов при 25 оС
- •5. Стандартные электродные потенциалы Еo в водных растворах при 25 оС
- •Литература
- •Оглавление
Закон Авогадро
В равных объемах различных газов при одинаковых внешних условиях (давлении и температуре) содержится одинаковое число молекул.
При решении задач используются 4 следствия из этого закона:
1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы.
Экспериментально
установлено, что любой газ химическим
количеством 1 моль, содержащий 6,02∙1023
молекул, при нормальных условиях (н. у.)
– температуре 0 оС
или 273 K,
и давлении 101,325 кПа – занимает объем,
равный 22,4 дм3.
Этот объем, отнесенный к количеству
газа, равному 1 моль, называется молярным
объемом газа
при н. у. и обозначается символом
![]() :
:
= 22,4 дм3/моль.
Следует помнить, что существует также понятие «молярный объем смеси газов». Эта величина обозначается (газ. см.) и представляет собой объем смеси газов, сумма химических количеств которых равна 1 моль. Как и молярный объем индивидуального газа, (газ. см.) равен примерно 22,4 дм3/моль.
Понятию «молярный объем газовой смеси» соответствует понятие «средняя молярная масса газовой смеси». Эта величина обозначается
![]() (газ.
см.) и численно равна отношению массы
данной смеси к сумме химических количеств
всех находящихся в ней газов:
(газ.
см.) и численно равна отношению массы
данной смеси к сумме химических количеств
всех находящихся в ней газов:
(газ.
см.) .
.
Физический смысл средней молярной массы газовой смеси: она численно равна массе смеси, в которой общее химическое количество газов равно 1 моль.
Средняя молярная масса газовой смеси связана с молярными массами образующих ее газов соотношением
![]() (газ.
см.) = φ(Х) · М(Х) + φ(Y) · M(Y).
(газ.
см.) = φ(Х) · М(Х) + φ(Y) · M(Y).
Здесь φ(X) и φ(Y) – объемные доли газов в смеси, М(X) и M(Y) – молярные массы газов. Объемная доля газа (φ) в смеси – величина, равная отношению объема газа Х к объему смеси:
 .
.
Как и массовая доля, она может выражаться в долях единицы или в процентах.
Поскольку в воздухе φ(О2) ≈ 0,21, а φ(N2) ≈ 0,78, то средняя молярная масса воздуха (возд.) составляет:
(возд) = φ(О2) · М(О2) + φ(N2) · M(N2) ≈ 0,21 · 32 + 0,78 · 28 ≈
≈ 29 г/моль.
Следует помнить, что объемные доли (φ) газов в смеси численно равны их мольным долям (χ):

2. Плотность газа – ρ – величина, численно равная отношению его молярной массы к молярному объему при н. у.:
ρ(X) =
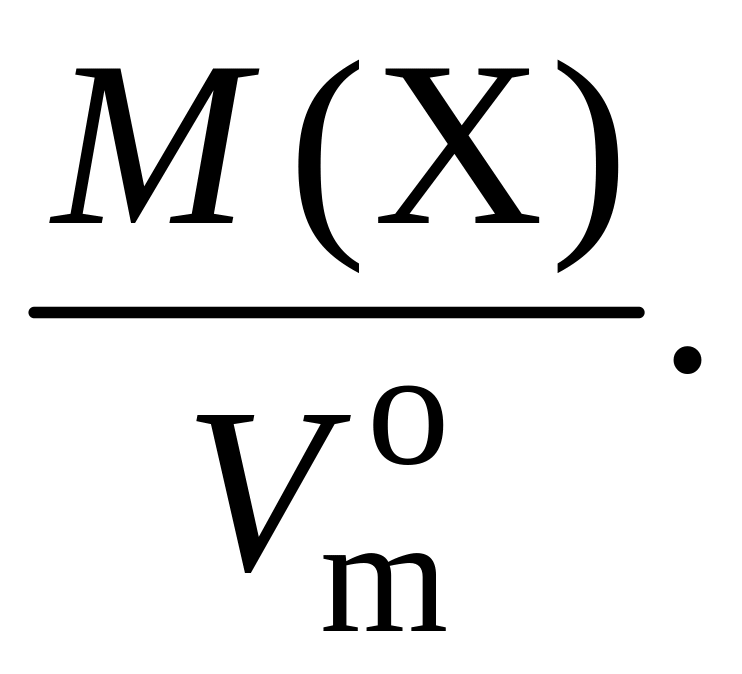
Единицы плотности газов – г/дм3, кг/м3 и т. п. Например, плотность кислорода при н. у. равна:
ρ(O2) =
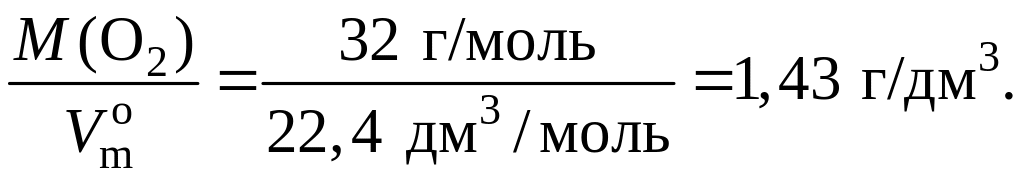
Физический смысл плотности газа в том, что она численно равна массе газа объемом 1 дм3 (н. у.).
Существует также понятие «плотность газовой смеси». Эта величина обозначается ρ(см.) и рассчитывается по формуле

Например, плотность воздуха при н. у. равна:

 = 1,295 г/дм3.
= 1,295 г/дм3.
3.
Относительная плотность газа Х
по газу Y
(![]() )
–
величина, численно равная отношению
молярных масс этих газов:
)
–
величина, численно равная отношению
молярных масс этих газов:

Относительная плотность одного газа по другому – величина безразмерная.
Физический смысл относительной плотности газа X по газу Y: она показывает, во сколько раз масса газа X при одних и тех же условиях больше массы газа Y, если их химические количества одинаковы:
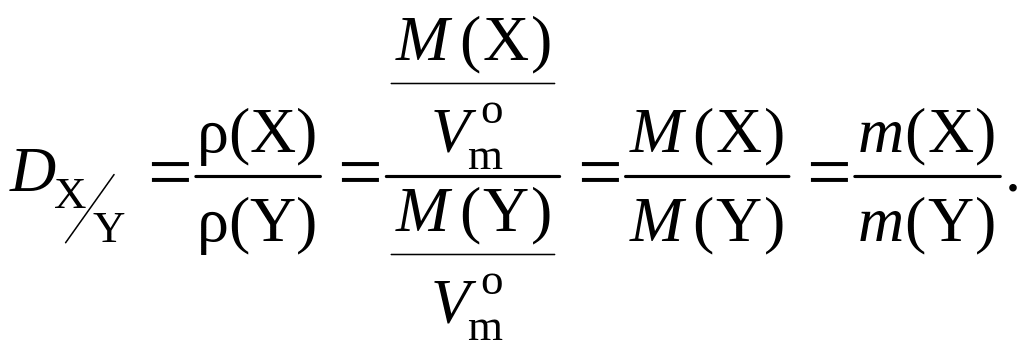
Наиболее часто при решении задач используются значения относительных плотностей газов по водороду и по воздуху, которые рассчитываются по формулам:
 и
и