
- •1. Общая химия
- •1.1. Атомно-молекулярное учение. Основные понятия и законы химии
- •Закон сохранения массы веществ
- •Закон постоянства состава веществ
- •Закон эквивалентов
- •Закон эквивалентов
- •6 Ионам соответствует 1 фе Al2(so4)3,
- •1 Иону соответствует х фе Al2(so4)3,
- •Закон Авогадро
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы.
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объемам данных газов, участвующих в этих реакциях.
- •Закон Бойля – Мариотта
- •Пример 1.1.12. При некоторой температуре и давлении 98,5 кПа объем газа равен 10,4 дм3. Вычислите объем данной порции газа при той же температуре и давлении 162,6 кПа.
- •Закон Шарля – Гей-Люссака
- •Объединенный газовый закон
- •Закон парциальных давлений газов (закон Дальтона)
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.2. Основные классы неорганических соединений
- •Бинарные соединения
- •Многоэлементные соединения
- •Задачи и упражнения
- •1.3. Энергетика химических реакций
- •Возможность и условия протекания реакции при различных сочетаниях знаков rH и rS
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.4. Основы химической кинетики. Химическое равновесие Факторы, влияющие на скорость химической реакции
- •Влияние температуры на скорость химической реакции
- •Химическое равновесие
- •Влияние изменения внешних условий на положение химического равновесия. Принцип Ле Шателье
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.5. Количественный состав растворов
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.6. Равновесия в растворах электролитов
- •Константа воды (ионное произведение воды). Водородный показатель
- •Константа растворимости (произведение растворимости)
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Константа гидролиза соли Kh
- •Связь между степенью и константой гидролиза соли
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.7. Строение атома и периодический закон д. И. Менделеева Вопросы для самостоятельной подготовки
- •1.8. Химическая связь и межмолекулярное взаимодействие Вопросы для самостоятельной подготовки
- •1.9. Окислительно-восстановительные реакции
- •Важнейшие восстановители
- •Важнейшие окислители:
- •Овр межмолекулярного типа
- •Овр внутримолекулярного типа
- •Расстановка коэффициентов в уравнениях овр методом электронного баланса
- •Электродные и окислительно-восстановительные потенциалы и их использование
- •Влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •Влияние концентраций потенциалопределяющих ионов
- •Влияние величины рН раствора
- •Влияние температуры на направление протекания овр
- •Влияние величины пр малорастворимого продукта на направление протекания овр
- •Влияние комплексообразования на направление протекания овр
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.10. Комплексные соединения
- •Cтроение и состав комплексных соединений
- •Классификация комплексных соединений
- •Номенклатура комплексных соединений Названия комплексообразователей
- •Названия лигандов
- •Названия комплексных соединений
- •Диссоциация комплексных соединений в водных растворах
- •Реакции с участием комплексных ионов Реакции ионного обмена
- •Реакции лигандного обмена
- •Реакции связывания лигандов
- •Реакции осаждения комплексообразователей
- •Реакции полного восстановления комплексообразователей
- •Химическая связь в комплексных соединениях. Геометрическая форма комплексных частиц
- •Важнейшие типы гибридизации орбиталей и соответствующие им геометрические конфигурации комплексных частиц
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •2. Неорганическая химия
- •2.1. Примерная схема описания группы элементов, их атомов и образованных ими простых и сложных веществ
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •2.8. Общая характеристика d-элементов Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Приложения
- •1. Стандартные энтальпии образования и стандартные энтропии некоторых веществ при 298 k
- •2. Константы диссоциации некоторых слабых электролитов в водных растворах при 25 оС
- •3. Произведения растворимости некоторых малорастворимых электролитов при 25 оС
- •4. Константы нестойкости некоторых комплексных ионов при 25 оС
- •5. Стандартные электродные потенциалы Еo в водных растворах при 25 оС
- •Литература
- •Оглавление
Реакции полного восстановления комплексообразователей
В ходе таких реакций комплексообразователь восстанавливается до простого вещества и выделяется из раствора в виде металлического осадка. Так, например, при добавлении цинка в раствор дицианоаурата(I) калия выделяется чистое золото:
Zn0
+ 2K[Au+(CN)2]
→ Au0↓
+ K2[![]() (CN)4].
(CN)4].
Эта реакция длительное время использовалась для промышленного получения золота по методу Багратиона.
Химическая связь в комплексных соединениях. Геометрическая форма комплексных частиц
Между ионами внешней и внутренней координационных сфер осуществляется ионная связь. Внутри комплексных частиц центральные атомы связаны с лигандами ковалентными связями, образованными по обменному и по донорно-акцепторному механизмам.
Для наглядного объяснения образования химической связи в комплексных частицах и их геометрической формы удобно использовать метод валентных связей (МВС).
Согласно этому методу химические связи между атомами комплексообразователей и лигандами образуются по донорно-акцепторному механизму, а геометрическая форма комплексных частиц определяется типом гибридизации орбиталей центральных атомов (табл. 4).
Таблица 4
Важнейшие типы гибридизации орбиталей и соответствующие им геометрические конфигурации комплексных частиц
Координационное число комплексообразователя |
Тип гибридизации орбиталей комплексообразователя |
Геометрическая форма комплексной частицы |
Примеры |
2 |
sp |
Линейная |
[Ag(NH3)2]+ |
3 |
sp2, sd2 |
Треугольная |
[HgI3] – |
4 |
sp3, sd3 |
Тетраэдрическая |
[FeCl4]2 – |
sp2d |
Квадратная |
[PtCl4]2 – |
|
5 |
sp3d |
Тригонально-бипирамидальная |
[Fe(CO)5] |
6 |
sp3d2 |
Октаэдрическая |
[Co(NH3)6]3+ |
Используя
МВС, рассмотрим образование химических
связей в комплексном катионе
гексаакваалюминия [А1(Н2О)6]3+
и его геометрическую форму. В этой
комплексной частице роль комплексообразователя
играет катион алюминия A13+,
образующийся в результате отщепления
от атома алюминия трех электронов: Al0
– 3![]() →
Al+3
(рис. 1).
→
Al+3
(рис. 1).
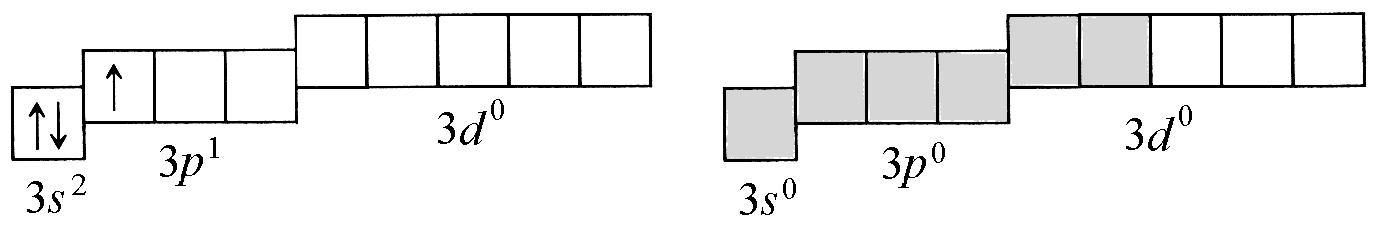
Al0: 1s22s22p63s23p13d0; Al+3: 1s22s22p63s03p03d0
Рис. 1. Схемы распределения валентных орбиталей в атоме и в катионе алюминия
В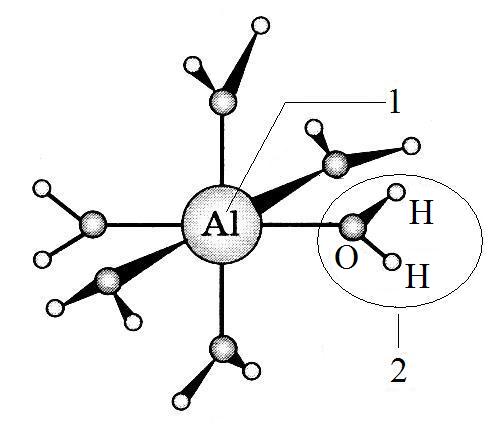 катионе А13+
имеются 6 вакантных орбиталей (выделены
серым цветом): одна – на 3s-,
три – на 3р-
и две на
3d-подуровне.
Они отличаются друг от друга своей
пространственной формой и энергией. Из
этих шести различных орбиталей образуются
шесть совершенно одинаковых по форме
и энергии гибридных
орбиталей (sp3d2-гибридизация).
Они располагаются в пространстве
октаэдрически и перекрываются с
орбиталями неподеленных электронных
пар шести молекул воды. При этом молекулы
Н2О
являются донорами
неподеленных
электронных
пар, а катион A13+
– их акцептором.
Так по донорно-акцепторному механизму
образуются 6 ковалентных связей Н2О→Al
в катионе гексаакваалюминия. Они, как
и гибридные орбитали катиона А13+,
имеют октаэдрическую направленность.
Поэтому комплексный катион [А1(Н2О)6]3+
представляет собой октаэдр (восьмигранник),
в центре которого расположен
комплексообразователь – катион алюминия,
а в вершинах находятся лиганды – молекулы
воды (рис. 2).
катионе А13+
имеются 6 вакантных орбиталей (выделены
серым цветом): одна – на 3s-,
три – на 3р-
и две на
3d-подуровне.
Они отличаются друг от друга своей
пространственной формой и энергией. Из
этих шести различных орбиталей образуются
шесть совершенно одинаковых по форме
и энергии гибридных
орбиталей (sp3d2-гибридизация).
Они располагаются в пространстве
октаэдрически и перекрываются с
орбиталями неподеленных электронных
пар шести молекул воды. При этом молекулы
Н2О
являются донорами
неподеленных
электронных
пар, а катион A13+
– их акцептором.
Так по донорно-акцепторному механизму
образуются 6 ковалентных связей Н2О→Al
в катионе гексаакваалюминия. Они, как
и гибридные орбитали катиона А13+,
имеют октаэдрическую направленность.
Поэтому комплексный катион [А1(Н2О)6]3+
представляет собой октаэдр (восьмигранник),
в центре которого расположен
комплексообразователь – катион алюминия,
а в вершинах находятся лиганды – молекулы
воды (рис. 2).
Рис. 2.
Пространственное строение катиона
гексаакваалюминия [А1(Н2О)6]3+: 1
– комплексообразователь – А13+;
2 – лиганд – молекула воды
