
- •1. Общая химия
- •1.1. Атомно-молекулярное учение. Основные понятия и законы химии
- •Закон сохранения массы веществ
- •Закон постоянства состава веществ
- •Закон эквивалентов
- •Закон эквивалентов
- •6 Ионам соответствует 1 фе Al2(so4)3,
- •1 Иону соответствует х фе Al2(so4)3,
- •Закон Авогадро
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы.
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объемам данных газов, участвующих в этих реакциях.
- •Закон Бойля – Мариотта
- •Пример 1.1.12. При некоторой температуре и давлении 98,5 кПа объем газа равен 10,4 дм3. Вычислите объем данной порции газа при той же температуре и давлении 162,6 кПа.
- •Закон Шарля – Гей-Люссака
- •Объединенный газовый закон
- •Закон парциальных давлений газов (закон Дальтона)
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.2. Основные классы неорганических соединений
- •Бинарные соединения
- •Многоэлементные соединения
- •Задачи и упражнения
- •1.3. Энергетика химических реакций
- •Возможность и условия протекания реакции при различных сочетаниях знаков rH и rS
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.4. Основы химической кинетики. Химическое равновесие Факторы, влияющие на скорость химической реакции
- •Влияние температуры на скорость химической реакции
- •Химическое равновесие
- •Влияние изменения внешних условий на положение химического равновесия. Принцип Ле Шателье
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.5. Количественный состав растворов
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.6. Равновесия в растворах электролитов
- •Константа воды (ионное произведение воды). Водородный показатель
- •Константа растворимости (произведение растворимости)
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Константа гидролиза соли Kh
- •Связь между степенью и константой гидролиза соли
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.7. Строение атома и периодический закон д. И. Менделеева Вопросы для самостоятельной подготовки
- •1.8. Химическая связь и межмолекулярное взаимодействие Вопросы для самостоятельной подготовки
- •1.9. Окислительно-восстановительные реакции
- •Важнейшие восстановители
- •Важнейшие окислители:
- •Овр межмолекулярного типа
- •Овр внутримолекулярного типа
- •Расстановка коэффициентов в уравнениях овр методом электронного баланса
- •Электродные и окислительно-восстановительные потенциалы и их использование
- •Влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •Влияние концентраций потенциалопределяющих ионов
- •Влияние величины рН раствора
- •Влияние температуры на направление протекания овр
- •Влияние величины пр малорастворимого продукта на направление протекания овр
- •Влияние комплексообразования на направление протекания овр
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.10. Комплексные соединения
- •Cтроение и состав комплексных соединений
- •Классификация комплексных соединений
- •Номенклатура комплексных соединений Названия комплексообразователей
- •Названия лигандов
- •Названия комплексных соединений
- •Диссоциация комплексных соединений в водных растворах
- •Реакции с участием комплексных ионов Реакции ионного обмена
- •Реакции лигандного обмена
- •Реакции связывания лигандов
- •Реакции осаждения комплексообразователей
- •Реакции полного восстановления комплексообразователей
- •Химическая связь в комплексных соединениях. Геометрическая форма комплексных частиц
- •Важнейшие типы гибридизации орбиталей и соответствующие им геометрические конфигурации комплексных частиц
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •2. Неорганическая химия
- •2.1. Примерная схема описания группы элементов, их атомов и образованных ими простых и сложных веществ
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •2.8. Общая характеристика d-элементов Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Приложения
- •1. Стандартные энтальпии образования и стандартные энтропии некоторых веществ при 298 k
- •2. Константы диссоциации некоторых слабых электролитов в водных растворах при 25 оС
- •3. Произведения растворимости некоторых малорастворимых электролитов при 25 оС
- •4. Константы нестойкости некоторых комплексных ионов при 25 оС
- •5. Стандартные электродные потенциалы Еo в водных растворах при 25 оС
- •Литература
- •Оглавление
Диссоциация комплексных соединений в водных растворах
Различают первичную и вторичную диссоциацию КС в растворах. Первичная диссоциация заключается в том, что катионные и анионные КС необратимо распадаются на ионы внешней и внутренней сфер, например:
[Ag(NH3)2]+Cl → [Ag(NH3)2]+ + Cl–;
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4–.
КС катионно-анионного типа при этом также необратимо распадаются на комплексные катионы и комплексные анионы;
[Cu(NH3)4][Zn(H2O)(CN)3]2 → [Cu(NH3)4]2+ + 2[Zn(H2O)(CN)3]–.
Вторичной диссоциации подвергаются комплексные частицы (внутренние сферы). Они обратимо и постадийно диссоциируют на составные части. Например, при вторичной диссоциации комплексный анион [Ag(NH3)2]+ обратимо и по стадиям отщепляет частицы лигандов – молекулы NH3. Поскольку в растворе при этом устанавливаются динамические равновесия, каждой стадии вторичной диссоциации соответствует своя константа равновесия. Она называется константой нестойкости (Kнест) комплексного иона по данной стадии:
1-я стадия: [Ag(NH3)2]+ ↔ [Ag(NH3)]+ + NH3;
 ;
;
2-я стадия: [Ag(NH3)]+ ↔ Ag+ + NH3;
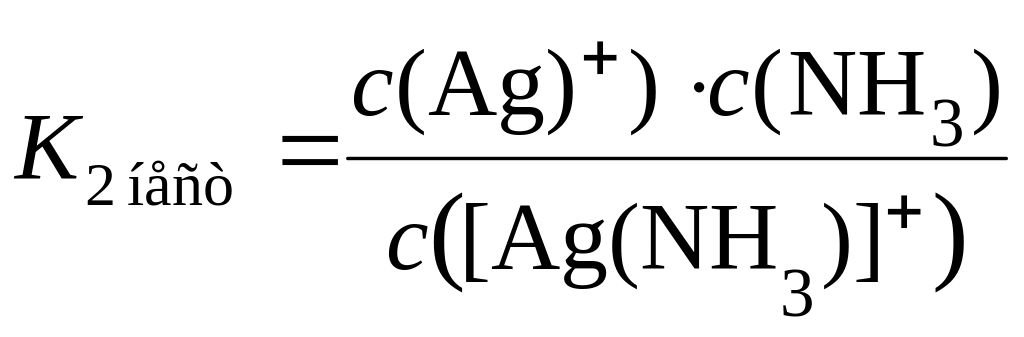 .
.
При этом всегда K1 нест > K2 нест. Но поскольку они отличаются не очень сильно, часто используют общую константу нестойкости комплексного иона Kнест. Она является константой равновесия суммарного процесса вторичной диссоциации:
[Ag(NH3)2]+ ↔ Ag+ + 2NH3;
 = K1 нест · K2
нест.
= K1 нест · K2
нест.
Для каждого комплексного иона при данной температуре Kнест – постоянная величина (приложение 4). Чем меньше ее значение, тем устойчивее комплексный ион в растворе, тем слабее протекает его вторичная диссоциация и наоборот.
Величина, обратная общей константе нестойкости комплексного иона, называтся общей константой его устойчивости Kуст:
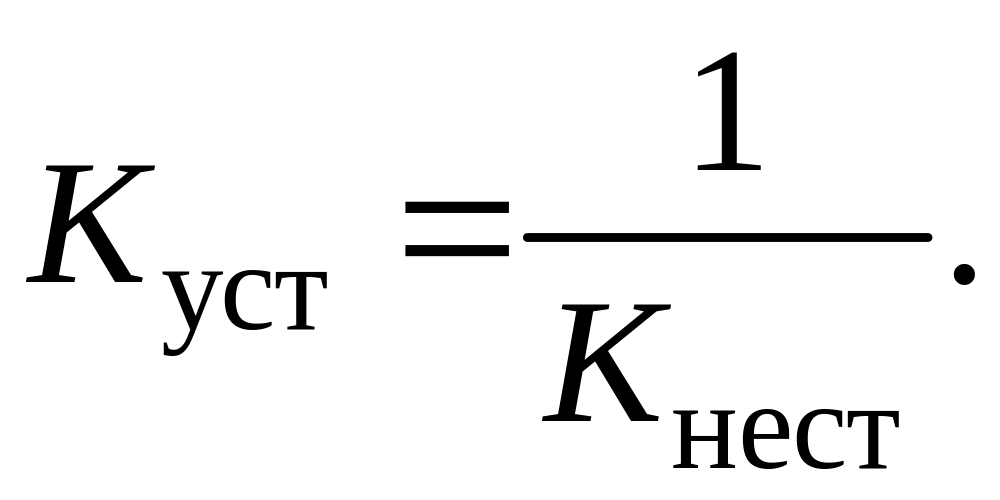
Соответственно чем больше Kуст комплексного иона, тем он устойчивее в растворе и наоборот.
Константы нестойкости комплексных ионов слабо зависят от температуры.
Пример 1.10.3. Напишите координационную формулу сульфата гексаамминкобальта(III). Укажите заряд и координационное число комплексообразователя, заряд внутренней сферы. Напишите уравнения первичной и вторичной диссоциации и выражение константы нестойкости комплексного иона.
Решение.
1) Сульфат гексаамминкобальта(III) – катионное КС состава [Co(NН3)6]2(SO4)3. Комплексообразователь – Со3+. Его координационное число в соответствии с правилом Вернера равно удвоенному значению заряда, т. е. 6. Лиганды – однодентатные молекулы аммиака. Заряд внутренней сферы, равный сумме заряда комплексообразователя и общего заряда всех лигандов, составляет 3+.
2) Уравнение первичной диссоциации КС (по типу сильного электролита):
[Co(NН3)6]2(SO4)3 → 2[Co(NН3)6]3+ + 3 SO42–.
3) Общее уравнение вторичной диссоциации комплексного иона (по типу слабого электролита):
[Co(NН3)6]3+ ↔ Со3+ + 6 NН3.
Выражение общей константы нестойкости комплексного иона:

Реакции с участием комплексных ионов Реакции ионного обмена
К таким реакциям относятся, например, многочисленные реакции обмена КС с обычными солями. При этом КС обмениваются с ними своими составными частями – внешней или внутренней сферами, например:
3Cu2+SO4 + 2K3[Fe(CN)6]3– → Cu32+[Fe(CN)6]23–↓ + 3K2SO4;
3Cu2+ + 3 SO42– + 6K+ + 2[Fe(CN)6]3– → Cu32+[Fe(CN)6]23–↓ + 6K+ +3SO42–;
3Cu2+ + 2[Fe(CN)6]3– → Cu32+[Fe(CN)6]23–↓.
Такие реакции протекают необратимо, если приводят к образованию малорастворимых продуктов.
