
- •1. Общая химия
- •1.1. Атомно-молекулярное учение. Основные понятия и законы химии
- •Закон сохранения массы веществ
- •Закон постоянства состава веществ
- •Закон эквивалентов
- •Закон эквивалентов
- •6 Ионам соответствует 1 фе Al2(so4)3,
- •1 Иону соответствует х фе Al2(so4)3,
- •Закон Авогадро
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы.
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объемам данных газов, участвующих в этих реакциях.
- •Закон Бойля – Мариотта
- •Пример 1.1.12. При некоторой температуре и давлении 98,5 кПа объем газа равен 10,4 дм3. Вычислите объем данной порции газа при той же температуре и давлении 162,6 кПа.
- •Закон Шарля – Гей-Люссака
- •Объединенный газовый закон
- •Закон парциальных давлений газов (закон Дальтона)
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.2. Основные классы неорганических соединений
- •Бинарные соединения
- •Многоэлементные соединения
- •Задачи и упражнения
- •1.3. Энергетика химических реакций
- •Возможность и условия протекания реакции при различных сочетаниях знаков rH и rS
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.4. Основы химической кинетики. Химическое равновесие Факторы, влияющие на скорость химической реакции
- •Влияние температуры на скорость химической реакции
- •Химическое равновесие
- •Влияние изменения внешних условий на положение химического равновесия. Принцип Ле Шателье
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.5. Количественный состав растворов
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.6. Равновесия в растворах электролитов
- •Константа воды (ионное произведение воды). Водородный показатель
- •Константа растворимости (произведение растворимости)
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Константа гидролиза соли Kh
- •Связь между степенью и константой гидролиза соли
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.7. Строение атома и периодический закон д. И. Менделеева Вопросы для самостоятельной подготовки
- •1.8. Химическая связь и межмолекулярное взаимодействие Вопросы для самостоятельной подготовки
- •1.9. Окислительно-восстановительные реакции
- •Важнейшие восстановители
- •Важнейшие окислители:
- •Овр межмолекулярного типа
- •Овр внутримолекулярного типа
- •Расстановка коэффициентов в уравнениях овр методом электронного баланса
- •Электродные и окислительно-восстановительные потенциалы и их использование
- •Влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •Влияние концентраций потенциалопределяющих ионов
- •Влияние величины рН раствора
- •Влияние температуры на направление протекания овр
- •Влияние величины пр малорастворимого продукта на направление протекания овр
- •Влияние комплексообразования на направление протекания овр
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.10. Комплексные соединения
- •Cтроение и состав комплексных соединений
- •Классификация комплексных соединений
- •Номенклатура комплексных соединений Названия комплексообразователей
- •Названия лигандов
- •Названия комплексных соединений
- •Диссоциация комплексных соединений в водных растворах
- •Реакции с участием комплексных ионов Реакции ионного обмена
- •Реакции лигандного обмена
- •Реакции связывания лигандов
- •Реакции осаждения комплексообразователей
- •Реакции полного восстановления комплексообразователей
- •Химическая связь в комплексных соединениях. Геометрическая форма комплексных частиц
- •Важнейшие типы гибридизации орбиталей и соответствующие им геометрические конфигурации комплексных частиц
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •2. Неорганическая химия
- •2.1. Примерная схема описания группы элементов, их атомов и образованных ими простых и сложных веществ
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •2.8. Общая характеристика d-элементов Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Приложения
- •1. Стандартные энтальпии образования и стандартные энтропии некоторых веществ при 298 k
- •2. Константы диссоциации некоторых слабых электролитов в водных растворах при 25 оС
- •3. Произведения растворимости некоторых малорастворимых электролитов при 25 оС
- •4. Константы нестойкости некоторых комплексных ионов при 25 оС
- •5. Стандартные электродные потенциалы Еo в водных растворах при 25 оС
- •Литература
- •Оглавление
Влияние комплексообразования на направление протекания овр
Если в результате ОВР образуются комплексные соединения, в которых роль комплексообразователя играют потенциалопределяющие ионы, то концентрация этих ионов в растворе резко уменьшается. Вследствие этого потенциалы соответствующих полуреакций изменяются, что может привести к изменению направления ОВР.
Пример 1.9.13. Определите направление протекания реакций при 25 оС в системах:
а) Hg + 4HBr ↔ H2 + H2[HgBr4];
б) Hg + 4HI ↔ H2 + H2[HgI4],
если концентрации HBr и HI в растворах равны 2 моль/дм3, концентрации ионов [HgBr4]2– и [HgI4]2– составляют 1 моль/ дм3, давление водорода равно 101,325 кПа.
Решение.
1. Рассчитаем концентрацию катионов Hg2+, образующихся в результате диссоциации анионов [HgBr4]2–. При этом допускаем, что общая концентрация ионов Br– в растворе равна концентрации HBr и составляет 2 моль/дм3:
Kнест ([HgBr4]2–)= .
.
Отсюда:
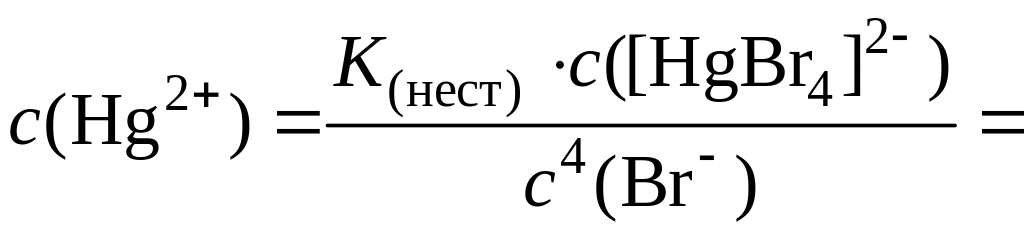
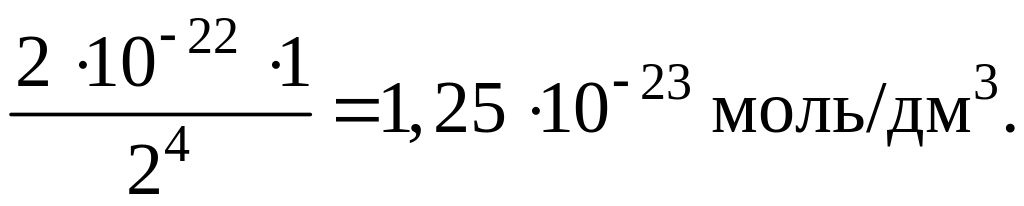
2.
Рассчитаем
равновесный потенциал
![]() при
данной концентрации ионов Hg2+:
при
данной концентрации ионов Hg2+:
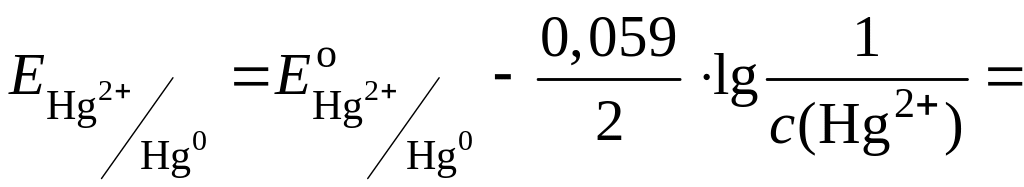
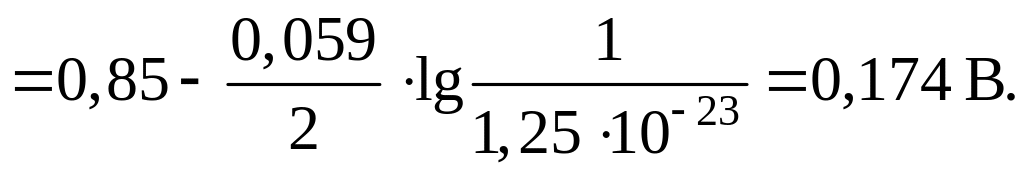
3.
Рассчитаем
потенциал
![]() ,
допустив, что концентрация ионов Н+
равна концентрации HI
и составляет 2 моль/дм3:
,
допустив, что концентрация ионов Н+
равна концентрации HI
и составляет 2 моль/дм3:
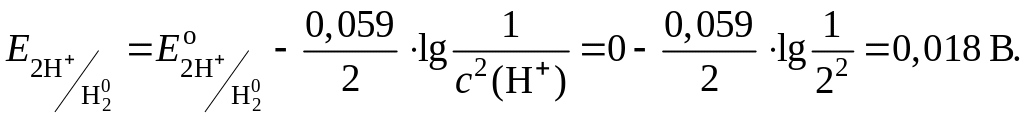
4. Определим направление протекания реакции а). Поскольку в данном случае более высоким является потенциал ртути, то ионы Hg2+ (образовавшиеся из [HgBr4]2–) окисляют молекулы водорода и реакция а) протекает справа налево.
5. Рассчитаем концентрацию ионов Hg2+, образующихся в результате диссоциации ионов [HgI4]2–. При этом допускаем, что общая концентрация ионов I– в растворе равна концентрации HI и составляет 2 моль/дм3:
Kнест [HgI4]2–
= .
.
Отсюда:
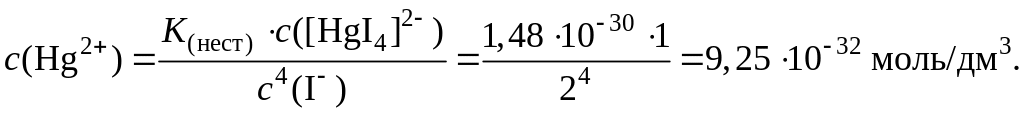
6. Рассчитаем равновесный потенциал при данной концентрации ионов Hg2+:

7. Определим направление протекания реакции б). Поскольку в данном случае более высоким является значение потенциала , то ионы H+ окисляют ртуть и реакция б) протекает слева направо.
По этой же причине медь вытесняет водород из водных растворов цианидов.
Вопросы для самостоятельной подготовки
1. Что такое степень окисления а. ч.? Какие значения она может принимать? Чему равна сумма степеней окисления атомов в молекуле; в ионе?
2. Какие реакции относятся к окислительно-восстановительным?
3. В чем заключаются с точки зрения электронной теории процессы окисления и восстановления? Как изменяются значения степеней окисления атомов в результате этих процессов?
4. Как зависят окислительно-восстановительные свойства веществ от значений степеней окисления а. ч., входящих в их состав?
5. Перечислите типичные восстановители.
6. Какие вещества являются типичными окислителями?
7. Приведите примеры веществ, которые в зависимости от условий могут проявлять как окислительные, так и восстановительные свойства? Как это можно объяснить?
8. Как классифицируются окислительно-восстановительные реакции? Чем отличаются реакции межмолекулярного окисления-восстановления от реакций внутримолекулярного окисления-восстановления; реакции диспропорционирования от реакций конпропорционирования?
9. Что является количественной характеристикой окислительно-восстановительных свойств веществ? Что представляет собой стандартный электродный (окислительно-восстановительный) потенциал?
10. Какие потенциалы называются равновесными? Как они связаны со стандартными электродными потенциалами? От каких факторов зависит величина равновесного потенциала?
11. Как связаны окислительно-восстановительные свойства веществ со значениями электродных потенциалов соответствующих полуреакций?
12. Как оценивается принципиальная возможность протекания ОВР в указанном направлении?
13. Как определяется направление протекания ОВР?
14. Как можно определить наиболее вероятную ОВР из нескольких возможных реакций?
15. Какова зависимость константы химического равновесия ОВР от значений электродных потенциалов полуреакций?
16. Какие факторы оказывают влияние на направление протекания ОВР? Охарактеризуйте влияние каждого из них.
17. Какова роль окислительно-восстановительных реакций в процессах жизнедеятельности?
18. В чем заключается принципиальное отличие ОВР, протекающих в живых организмах, от ОВР, протекающих в неживой природе?
