
- •1. Общая химия
- •1.1. Атомно-молекулярное учение. Основные понятия и законы химии
- •Закон сохранения массы веществ
- •Закон постоянства состава веществ
- •Закон эквивалентов
- •Закон эквивалентов
- •6 Ионам соответствует 1 фе Al2(so4)3,
- •1 Иону соответствует х фе Al2(so4)3,
- •Закон Авогадро
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы.
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объемам данных газов, участвующих в этих реакциях.
- •Закон Бойля – Мариотта
- •Пример 1.1.12. При некоторой температуре и давлении 98,5 кПа объем газа равен 10,4 дм3. Вычислите объем данной порции газа при той же температуре и давлении 162,6 кПа.
- •Закон Шарля – Гей-Люссака
- •Объединенный газовый закон
- •Закон парциальных давлений газов (закон Дальтона)
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.2. Основные классы неорганических соединений
- •Бинарные соединения
- •Многоэлементные соединения
- •Задачи и упражнения
- •1.3. Энергетика химических реакций
- •Возможность и условия протекания реакции при различных сочетаниях знаков rH и rS
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.4. Основы химической кинетики. Химическое равновесие Факторы, влияющие на скорость химической реакции
- •Влияние температуры на скорость химической реакции
- •Химическое равновесие
- •Влияние изменения внешних условий на положение химического равновесия. Принцип Ле Шателье
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.5. Количественный состав растворов
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.6. Равновесия в растворах электролитов
- •Константа воды (ионное произведение воды). Водородный показатель
- •Константа растворимости (произведение растворимости)
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Константа гидролиза соли Kh
- •Связь между степенью и константой гидролиза соли
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.7. Строение атома и периодический закон д. И. Менделеева Вопросы для самостоятельной подготовки
- •1.8. Химическая связь и межмолекулярное взаимодействие Вопросы для самостоятельной подготовки
- •1.9. Окислительно-восстановительные реакции
- •Важнейшие восстановители
- •Важнейшие окислители:
- •Овр межмолекулярного типа
- •Овр внутримолекулярного типа
- •Расстановка коэффициентов в уравнениях овр методом электронного баланса
- •Электродные и окислительно-восстановительные потенциалы и их использование
- •Влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •Влияние концентраций потенциалопределяющих ионов
- •Влияние величины рН раствора
- •Влияние температуры на направление протекания овр
- •Влияние величины пр малорастворимого продукта на направление протекания овр
- •Влияние комплексообразования на направление протекания овр
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.10. Комплексные соединения
- •Cтроение и состав комплексных соединений
- •Классификация комплексных соединений
- •Номенклатура комплексных соединений Названия комплексообразователей
- •Названия лигандов
- •Названия комплексных соединений
- •Диссоциация комплексных соединений в водных растворах
- •Реакции с участием комплексных ионов Реакции ионного обмена
- •Реакции лигандного обмена
- •Реакции связывания лигандов
- •Реакции осаждения комплексообразователей
- •Реакции полного восстановления комплексообразователей
- •Химическая связь в комплексных соединениях. Геометрическая форма комплексных частиц
- •Важнейшие типы гибридизации орбиталей и соответствующие им геометрические конфигурации комплексных частиц
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •2. Неорганическая химия
- •2.1. Примерная схема описания группы элементов, их атомов и образованных ими простых и сложных веществ
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •2.8. Общая характеристика d-элементов Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Приложения
- •1. Стандартные энтальпии образования и стандартные энтропии некоторых веществ при 298 k
- •2. Константы диссоциации некоторых слабых электролитов в водных растворах при 25 оС
- •3. Произведения растворимости некоторых малорастворимых электролитов при 25 оС
- •4. Константы нестойкости некоторых комплексных ионов при 25 оС
- •5. Стандартные электродные потенциалы Еo в водных растворах при 25 оС
- •Литература
- •Оглавление
Количественные характеристики гидролиза
Количественно гидролиз соли характеризуется степенью гидролиза и константой гидролиза.
Степень гидролиза соли – h – физическая величина, равная отношению числа ФЕ прогидролизовавшейся соли к общему числу ФЕ соли, внесенной в раствор:
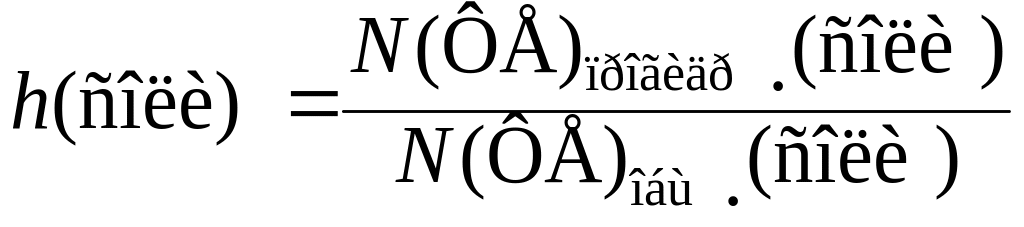
Поскольку число ФЕ соли прямо пропорционально ее химическому количеству или молярной концентрации, степень гидролиза соли можно выражать и через указанные величины:

Константа гидролиза соли Kh
1. Соль образована сильным основанием и слабой кислотой. Выведем константу гидролиза карбоната натрия Na2CO3. Эта соль гидролизуется по аниону:
CO32– + HOH ↔ (HCO3)– + ОH–.
Константа равновесия данного процесса выражается так:
K =
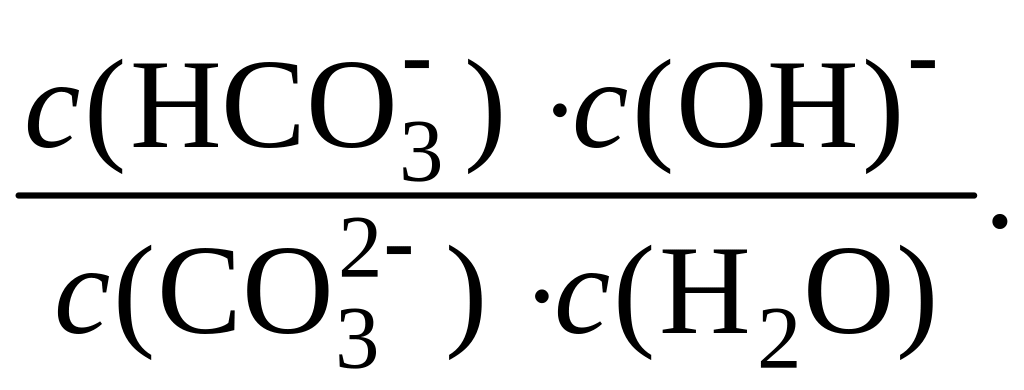
Поскольку равновесная концентрация воды в растворе с(H2O) практически равна ее общей концентрации, т. е. является величиной постоянной (55,56 моль/дм3), последнее уравнение можно записать в виде:
K· с(H2O)
= Kh
=
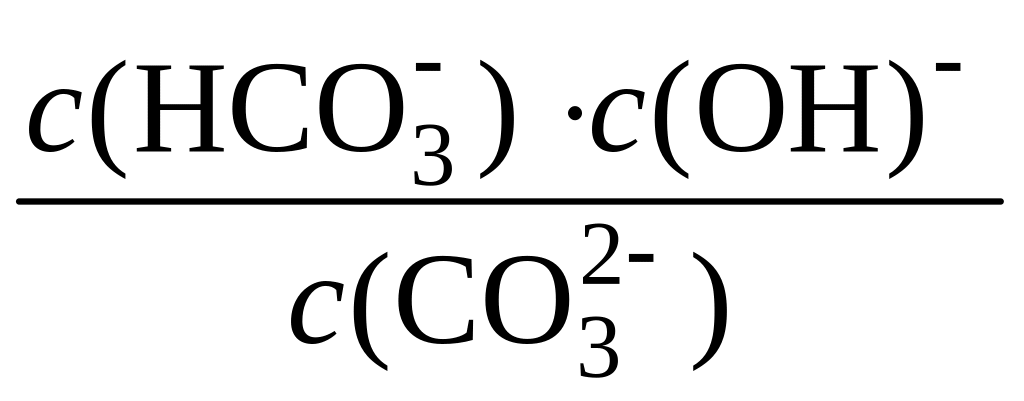 .
.
Поскольку
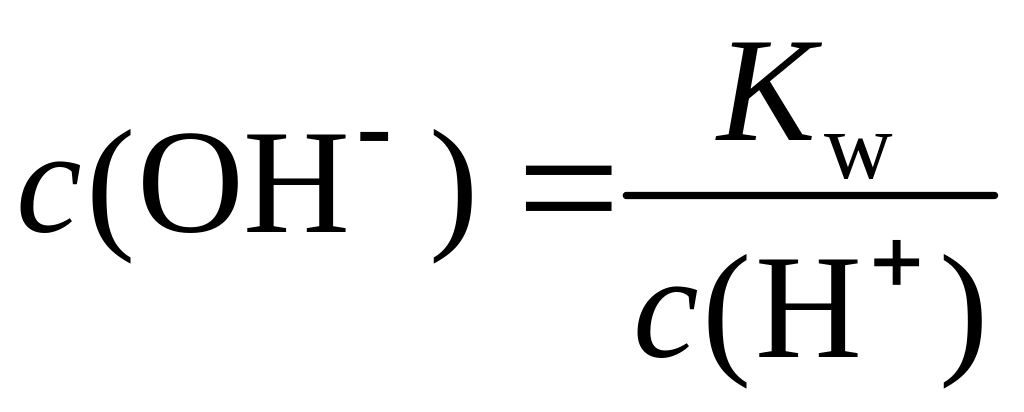 ,
подставив ее в предыдущее уравнение,
получим:
,
подставив ее в предыдущее уравнение,
получим:
Kh
=
 .
.
Учитывая,
что
 ,
окончательное выражение константы
гидролиза Na2CO3
имеет вид:
,
окончательное выражение константы
гидролиза Na2CO3
имеет вид:
Kh(Na2CO3)
=

Таким образом, константа гидролиза соли, образованной сильным основанием и слабой кислотой, – физическая величина, равная отношению константы воды к соответствующей константе диссоциации слабой кислоты, образовавшей эту соль.
При этом, как правило, порядок константы диссоциации (KI, KII, KIII) слабой кислоты равен абсолютному значению заряда ее аниона, входящего в состав соли. Так, в рассмотренном выше примере используется константа диссоциации угольной кислоты по второй стадии (KII), поскольку заряд иона равен 2–. В соответствии с этим константы гидролиза солей ортофосфорной кислоты выражаются так:
Kh(Na3PO4)
=
 ,
т. к. в состав соли
входят ионы (PO4)3–;
,
т. к. в состав соли
входят ионы (PO4)3–;
Kh(Na2HPO4)
=
 ,
т. к. в состав соли
входят ионы (НPO4)2–;
,
т. к. в состав соли
входят ионы (НPO4)2–;
Kh(NaH2PO4)
=
 ,
т. к. в состав соли
входят ионы (Н2PO4)1–.
,
т. к. в состав соли
входят ионы (Н2PO4)1–.
2. Соль образована слабым основанием и сильной кислотой. Константа гидролиза соли, образованной слабым основанием и сильной кислотой, – физическая величина, равная отношению константы воды к соответствующей константе диссоциации слабого основания, образовавшего эту соль.
Например, константа диссоциации хлорида аммония имеет вид:
Kh(NH4Cl)
=

3. Соль образована слабым основанием и слабой кислотой. Константа гидролиза соли, образованной слабым основанием и слабой кислотой, – физическая величина, равная отношению константы воды к произведению соответствующих констант диссоциации слабого основания и слабой кислоты, образовавших эту соль.
Например, константа диссоциации нитрита аммония имеет вид:
Kh(NH4NO2)
=

Величина константы гидролиза соли зависит от природы соли и температуры раствора:
а) чем меньше константа диссоциации слабого(ых) электролита (ов), образовавшего (их) соль, тем больше константа ее гидролиза, тем интенсивнее гидролизуется соль;
б) поскольку гидролиз соли – процесс эндотермический, то при повышении температуры константа гидролиза возрастает и соль гидролизуется интенсивнее.
