
- •1. Общая химия
- •1.1. Атомно-молекулярное учение. Основные понятия и законы химии
- •Закон сохранения массы веществ
- •Закон постоянства состава веществ
- •Закон эквивалентов
- •Закон эквивалентов
- •6 Ионам соответствует 1 фе Al2(so4)3,
- •1 Иону соответствует х фе Al2(so4)3,
- •Закон Авогадро
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы.
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объемам данных газов, участвующих в этих реакциях.
- •Закон Бойля – Мариотта
- •Пример 1.1.12. При некоторой температуре и давлении 98,5 кПа объем газа равен 10,4 дм3. Вычислите объем данной порции газа при той же температуре и давлении 162,6 кПа.
- •Закон Шарля – Гей-Люссака
- •Объединенный газовый закон
- •Закон парциальных давлений газов (закон Дальтона)
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.2. Основные классы неорганических соединений
- •Бинарные соединения
- •Многоэлементные соединения
- •Задачи и упражнения
- •1.3. Энергетика химических реакций
- •Возможность и условия протекания реакции при различных сочетаниях знаков rH и rS
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.4. Основы химической кинетики. Химическое равновесие Факторы, влияющие на скорость химической реакции
- •Влияние температуры на скорость химической реакции
- •Химическое равновесие
- •Влияние изменения внешних условий на положение химического равновесия. Принцип Ле Шателье
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.5. Количественный состав растворов
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.6. Равновесия в растворах электролитов
- •Константа воды (ионное произведение воды). Водородный показатель
- •Константа растворимости (произведение растворимости)
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Константа гидролиза соли Kh
- •Связь между степенью и константой гидролиза соли
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.7. Строение атома и периодический закон д. И. Менделеева Вопросы для самостоятельной подготовки
- •1.8. Химическая связь и межмолекулярное взаимодействие Вопросы для самостоятельной подготовки
- •1.9. Окислительно-восстановительные реакции
- •Важнейшие восстановители
- •Важнейшие окислители:
- •Овр межмолекулярного типа
- •Овр внутримолекулярного типа
- •Расстановка коэффициентов в уравнениях овр методом электронного баланса
- •Электродные и окислительно-восстановительные потенциалы и их использование
- •Влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •Влияние концентраций потенциалопределяющих ионов
- •Влияние величины рН раствора
- •Влияние температуры на направление протекания овр
- •Влияние величины пр малорастворимого продукта на направление протекания овр
- •Влияние комплексообразования на направление протекания овр
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.10. Комплексные соединения
- •Cтроение и состав комплексных соединений
- •Классификация комплексных соединений
- •Номенклатура комплексных соединений Названия комплексообразователей
- •Названия лигандов
- •Названия комплексных соединений
- •Диссоциация комплексных соединений в водных растворах
- •Реакции с участием комплексных ионов Реакции ионного обмена
- •Реакции лигандного обмена
- •Реакции связывания лигандов
- •Реакции осаждения комплексообразователей
- •Реакции полного восстановления комплексообразователей
- •Химическая связь в комплексных соединениях. Геометрическая форма комплексных частиц
- •Важнейшие типы гибридизации орбиталей и соответствующие им геометрические конфигурации комплексных частиц
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •2. Неорганическая химия
- •2.1. Примерная схема описания группы элементов, их атомов и образованных ими простых и сложных веществ
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •2.8. Общая характеристика d-элементов Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Приложения
- •1. Стандартные энтальпии образования и стандартные энтропии некоторых веществ при 298 k
- •2. Константы диссоциации некоторых слабых электролитов в водных растворах при 25 оС
- •3. Произведения растворимости некоторых малорастворимых электролитов при 25 оС
- •4. Константы нестойкости некоторых комплексных ионов при 25 оС
- •5. Стандартные электродные потенциалы Еo в водных растворах при 25 оС
- •Литература
- •Оглавление
Константа воды (ионное произведение воды). Водородный показатель
Вода, будучи очень слабым электролитом, диссоциирует в незначительной степени, образуя ионы водорода и гидроксид-ионы:
Н2О ↔ Н+ + ОН–.
Этому процессу соответствует константа диссоциации:
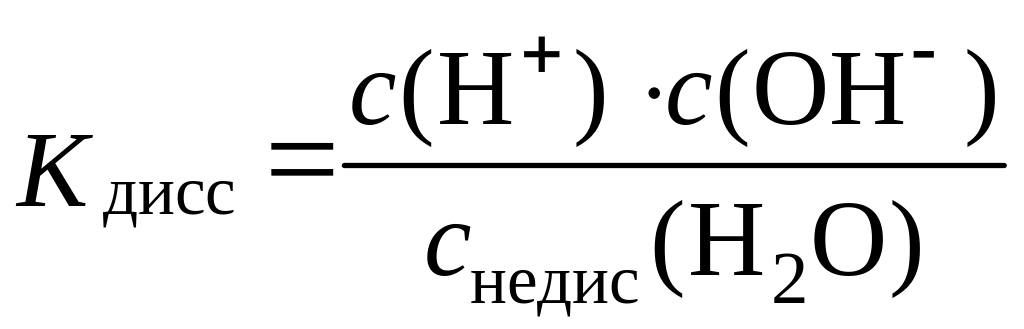 =
1,8·10–16 (при 22 оС).
=
1,8·10–16 (при 22 оС).
Поскольку степень диссоциации воды чрезвычайно мала, то равновесная концентрация ее недиссоциированных молекул снедисс(Н2О) практически равна общей концентрации воды: снедис(Н2О) = собщ(Н2О) = 55,55 моль/дм3 (поскольку 1000 г : 18 г/моль = 55,55 моль). Тогда выражение константы диссоциации воды можно преобразовать следующим образом:
с(Н+) · с(ОН– ) = Kдисс · собщ(Н2О) = 1,8 · 10–16 · 55,55 = 10–14 = Kw,
Константа Kw называется константой воды или ионным произведением воды. Ее физический смысл заключается в том, что в чистой воде или в любом водном растворе при 22 оС произведение молярных концентраций ионов Н+ и ОН– равно 10–14.
Диссоциация воды – эндотермический процесс, поэтому при увеличении температуры диссоциация молекул Н2О усиливается и значение Kw возрастает:
T, oC 10 22 30 50 100
Kw ∙ 10–14 0,36 1,00 1,89 5,60 74,00
В чистой воде концентрации ионов водорода и гидроксид-ионов одинаковы и при 22 оС составляют 10–7 моль/дм3.
Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами. В нейтральных растворах при 22 оС с(Н+) = с(ОН–) = 10–7 моль/дм3.
В кислых растворах концентрация ионов водорода выше концентрации гидроксид-ионов:
с(Н+) > с(ОН–) и с(Н+) > 10–7 моль/дм3 (при 22 оС).
В щелочных растворах концентрации ионов водорода ниже концентрации гидроксид-ионов:
с(Н+) < с(ОН–) и с(Н+) < 10–7 моль/дм3 (при 22 оС).
Вместо концентраций ионов Н+ и ОН- удобнее пользоваться их отрицательными десятичными логарифмами; эти величины обозначаются символами pH и pOH и называются соответственно водородным и гидроксидным показателями:
pH = – lg c(H+); pOH = – lg c(OH–).
С учетом этого для чистой воды и любого нейтрального раствора при 22 оС:
рН = – lg10–7 = 7; pOH = – lg10–7 = 7.
Таким образом, при 22 оС для чистой воды и нейтральных растворов pH = pOH = 7, а сумма pH + pOH = 14; для кислых растворов рН<7, а для щелочных растворов pH > 7.
Пример 1.6.3. Определите pH и рОН водного раствора серной кислоты, если ее молярная концентрация равна 0,020 моль/дм3.
Решение.
1. Найдем концентрацию ионов H+ в растворе:
Поскольку серная кислота – сильный электролит, то в разбавленном растворе она диссоциирует полностью: H2SO4 2H+ + . Из этого уравнения видно, что концентрация ионов водорода в 2 раза больше концентрации кислоты:
с(Н+) = 2 с(H2SO4) = 2 · 0,02 = 0,040 моль/дм3.
2. Найдем рН раствора:
pH = – lg с(H+) = – lg 0,04 = 1,4.
3. Из равенства pH + pOH = 14 следует, что:
pOH = 14 – 1,4 = 12,6.
Пример 1.6.4. Рассчитайте молярную концентрацию хлороводорода в растворе, если его водородный показатель равен 1,85.
Решение.
1. Зная рН раствора, найдем концентрацию ионов водорода в нем:
с(Н+) = 10– рН = 10–1,85 = 1,4 ∙ 10–2 моль/дм3.
2. Найдем концентрацию хлороводорода.
Поскольку хлороводород диссоциирует в растворе полностью по схеме:
HCl → H+ + Cl–,
то его концентрация равна концентрации ионов водорода. Поэтому:
с(HCl) = с(Н+) = 1,4 ∙ 10–2 моль/дм3.
