
- •1. Общая химия
- •1.1. Атомно-молекулярное учение. Основные понятия и законы химии
- •Закон сохранения массы веществ
- •Закон постоянства состава веществ
- •Закон эквивалентов
- •Закон эквивалентов
- •6 Ионам соответствует 1 фе Al2(so4)3,
- •1 Иону соответствует х фе Al2(so4)3,
- •Закон Авогадро
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы.
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объемам данных газов, участвующих в этих реакциях.
- •Закон Бойля – Мариотта
- •Пример 1.1.12. При некоторой температуре и давлении 98,5 кПа объем газа равен 10,4 дм3. Вычислите объем данной порции газа при той же температуре и давлении 162,6 кПа.
- •Закон Шарля – Гей-Люссака
- •Объединенный газовый закон
- •Закон парциальных давлений газов (закон Дальтона)
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.2. Основные классы неорганических соединений
- •Бинарные соединения
- •Многоэлементные соединения
- •Задачи и упражнения
- •1.3. Энергетика химических реакций
- •Возможность и условия протекания реакции при различных сочетаниях знаков rH и rS
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.4. Основы химической кинетики. Химическое равновесие Факторы, влияющие на скорость химической реакции
- •Влияние температуры на скорость химической реакции
- •Химическое равновесие
- •Влияние изменения внешних условий на положение химического равновесия. Принцип Ле Шателье
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.5. Количественный состав растворов
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.6. Равновесия в растворах электролитов
- •Константа воды (ионное произведение воды). Водородный показатель
- •Константа растворимости (произведение растворимости)
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Константа гидролиза соли Kh
- •Связь между степенью и константой гидролиза соли
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.7. Строение атома и периодический закон д. И. Менделеева Вопросы для самостоятельной подготовки
- •1.8. Химическая связь и межмолекулярное взаимодействие Вопросы для самостоятельной подготовки
- •1.9. Окислительно-восстановительные реакции
- •Важнейшие восстановители
- •Важнейшие окислители:
- •Овр межмолекулярного типа
- •Овр внутримолекулярного типа
- •Расстановка коэффициентов в уравнениях овр методом электронного баланса
- •Электродные и окислительно-восстановительные потенциалы и их использование
- •Влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •Влияние концентраций потенциалопределяющих ионов
- •Влияние величины рН раствора
- •Влияние температуры на направление протекания овр
- •Влияние величины пр малорастворимого продукта на направление протекания овр
- •Влияние комплексообразования на направление протекания овр
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.10. Комплексные соединения
- •Cтроение и состав комплексных соединений
- •Классификация комплексных соединений
- •Номенклатура комплексных соединений Названия комплексообразователей
- •Названия лигандов
- •Названия комплексных соединений
- •Диссоциация комплексных соединений в водных растворах
- •Реакции с участием комплексных ионов Реакции ионного обмена
- •Реакции лигандного обмена
- •Реакции связывания лигандов
- •Реакции осаждения комплексообразователей
- •Реакции полного восстановления комплексообразователей
- •Химическая связь в комплексных соединениях. Геометрическая форма комплексных частиц
- •Важнейшие типы гибридизации орбиталей и соответствующие им геометрические конфигурации комплексных частиц
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •2. Неорганическая химия
- •2.1. Примерная схема описания группы элементов, их атомов и образованных ими простых и сложных веществ
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •2.8. Общая характеристика d-элементов Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Приложения
- •1. Стандартные энтальпии образования и стандартные энтропии некоторых веществ при 298 k
- •2. Константы диссоциации некоторых слабых электролитов в водных растворах при 25 оС
- •3. Произведения растворимости некоторых малорастворимых электролитов при 25 оС
- •4. Константы нестойкости некоторых комплексных ионов при 25 оС
- •5. Стандартные электродные потенциалы Еo в водных растворах при 25 оС
- •Литература
- •Оглавление
1.5. Количественный состав растворов
Раствор – это гомогенная система, состоящая из двух или более веществ. Вещества, составляющие раствор, называются компонентами раствора. Растворы бывают газообразные, жидкие и твердые.
Для биологии и медицины наибольший интерес представляют жидкие водные растворы. Любой раствор состоит из растворенных веществ и растворителя, хотя эти понятия в известной степени условны. Обычно растворителем считается тот компонент, который в растворе находится в том же агрегатном состоянии, что и до его образования. Например, в водном растворе глюкозы (твердое вещество) растворителем является вода, а смесь спирта (жидкость) и воды (жидкость) можно назвать в зависимости от количества компонентов раствором спирта в воде или раствором воды в спирте.
В растворах электролитов вне зависимости от соотношения компонентов и их агрегатного состояния электролиты всегда рассматриваются как растворенные вещества.
Свойства растворов определяются их качественным и количественным составом. На практике для выражения количественного состава растворов используют следующие величины:
а) безразмерные – массовая, объемная и мольная доли;
б) размерные – массовая концентрация, молярная концентрация, молярная концентрация эквивалентов вещества и моляльность.
Массовая доля растворенного вещества – w – физическая величина, численно равная отношению массы растворенного вещества m(Х) к общей массе раствора:
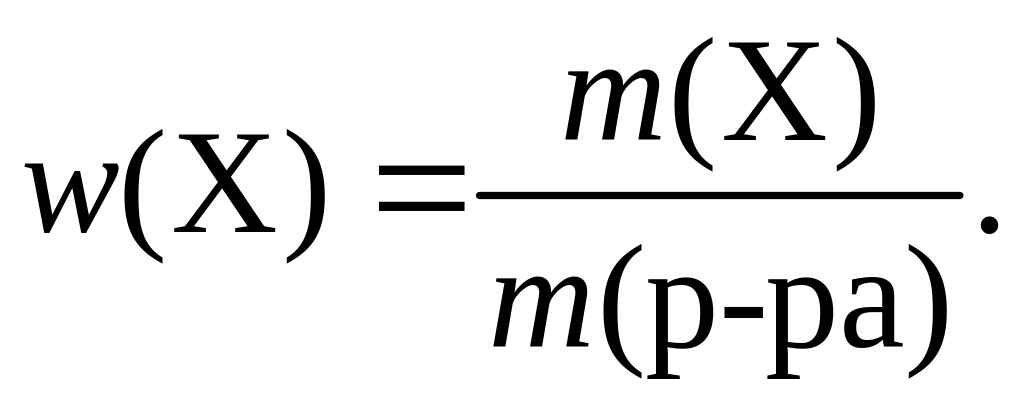
Массовая доля выражается в долях единицы, процентах (%), промилле (‰) и (для очень разбавленных растворов) в миллионных долях (ppm, или млнˉ1). Например, если в растворе массой 100 г содержится аммиак массой 3 г, то его массовая доля в растворе составляет 0,03, или 3 %, или 30 ‰.
Объемная доля растворенного вещества – – физическая величина, численно равная отношению объема жидкого (или газообразного) вещества V(Х) к общему объему раствора (или газовой смеси):

Объемная доля, как и массовая, выражается в долях единицы, процентах (%) и промилле (‰). Для водных растворов этилового спирта 1 объемный процент принято обозначать как 1о (1 градус).
Если, например, объемная доля O2 в воздухе составляет 21 %, это значит, что в воздухе объемом 100 дм3 содержится кислород объемом 21 дм3. Если объемная доля этилового спирта в растворе составляет 96 % (96º), то в данном растворе объемом 100 см3 содержится этанол объемом 96 см3.
Мольная доля растворенного вещества – – физическая величина, численно равная отношению химического количества растворенного вещества n(Х) к общему химическому количеству всех компонентов раствора:

Она выражается так же в долях единицы или в процентах.
Массовая концентрация (титр) вещества – T(X) – физическая величина, численно равная отношению массы растворенного вещества к объему раствора:

Единицы массовой концентрации: кг/дм3, г/см3, г/дм3, г/см3, мг/см3. В клинической практике массовую концентрацию ионов часто выражают в миллиграммах на 100 см3 раствора (мг-%).
Молярная концентрация вещества – с(X) – физическая величина, численно равная отношению химического количества растворенного вещества к объему раствора:
![]() .
.
Она выражается в моль/дм3.
Иногда на практике используют сокращенное обозначение молярной концентрации. Оно состоит из числа, большой буквы М и формулы вещества, например, «0,2 М HCl», что равнозначно записи: с(HCl) = 0,2 моль/дм3.
Молярная
концентрация эквивалентов вещества
(эквивалентная концентрация)
–
 – физическая
величина,
численно
равна отношению химического количества
эквивалентов растворенного вещества
– физическая
величина,
численно
равна отношению химического количества
эквивалентов растворенного вещества
 к объему раствора:
к объему раствора:

Она также выражается в моль/дм3.
Моляльность растворенного вещества – b(X) – физическая величина, численно равная отношению химического количества растворенного вещества к массе растворителя:
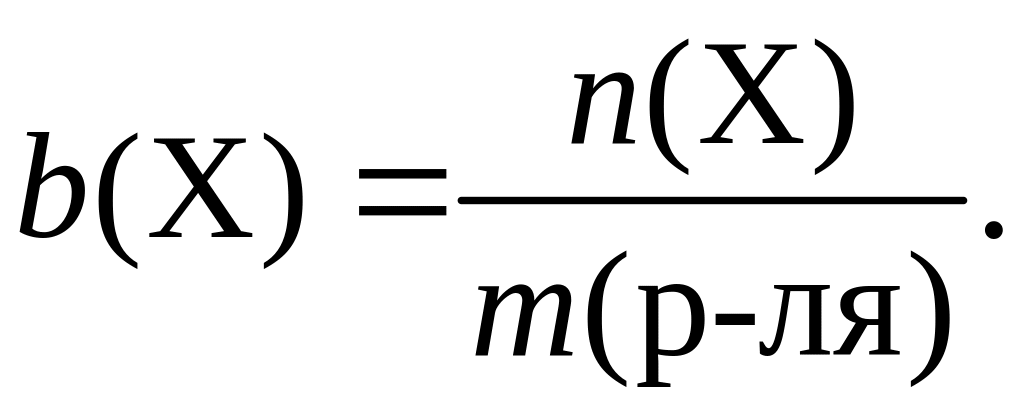
Единицы моляльности – моль/кг.
Коэффициент растворимости вещества (растворимость) – s – максимальная масса вещества, способная раствориться в воде массой 100 г при данной температуре с образованием насыщенного раствора.
Коэффициентом растворимости также называют молярную концентрацию вещества в его насыщенном растворе при данной температуре.
Как правило, растворимость большинства твердых веществ при нагревании увеличивается.
Растворимость газов увеличивается при понижении температуры, а также при повышении давления газов над жидкими растворителями. Эта зависимость выражается законом Генри: Растворимость газа при постоянной температуре прямо пропорциональна его давлению над растворителем:
s(X) = k · p(X).
Пример 1.5.1. Рассчитайте объемы воды и раствора BaCl2 с массовой долей соли 10 % (ρ = 1,09 г/см3), необходимые для приготовления нового раствора объемом 1,0 дм3 с массовой долей соли, равной 2,0 %, и плотностью 1,012 г/см3.
Решение.
1. Вычислим массу нового раствора объемом 1,0 дм3:
m(р-ра) = V(р-ра) · ρ(р-ра) = 1000 см3 1,012 г/см3 = 1012 г;
2. Вычислим массу BaCl2 в полученном растворе m(BaCl2):
в растворе массой 100 г содержится BaCl2 массой 2 г,
в растворе массой 1012 г содержится BaCl2 массой x г,
![]() = 20,2 г.
= 20,2 г.
3. Вычислим массу исходного раствора, содержащего соль массой 20,2 г:
в растворе массой 100 г содержится BaCl2 массой 10 г,
в растворе массой y г содержится BaCl2 массой 20,2 г,
![]() = 202 г.
= 202 г.
4. Вычислим объем исходного раствора массой 202 г:
V(р-ра) =
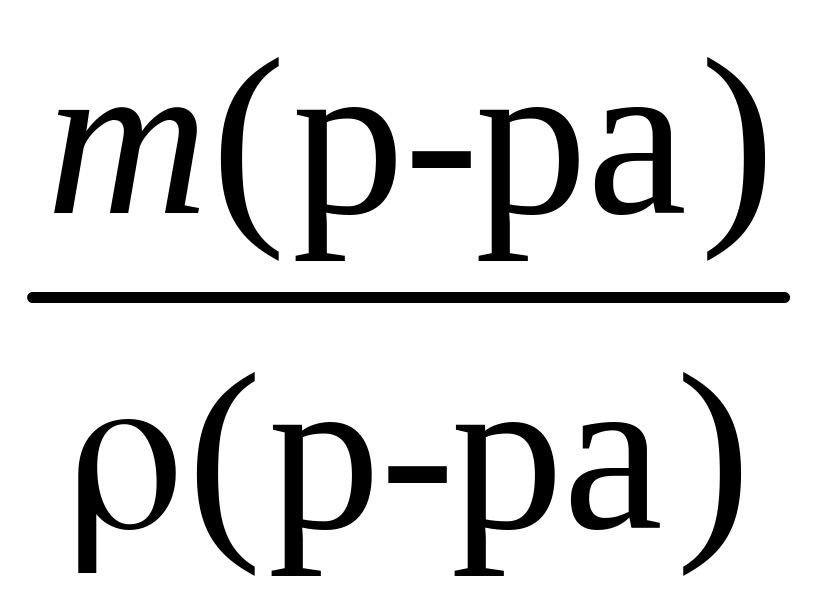 =
=
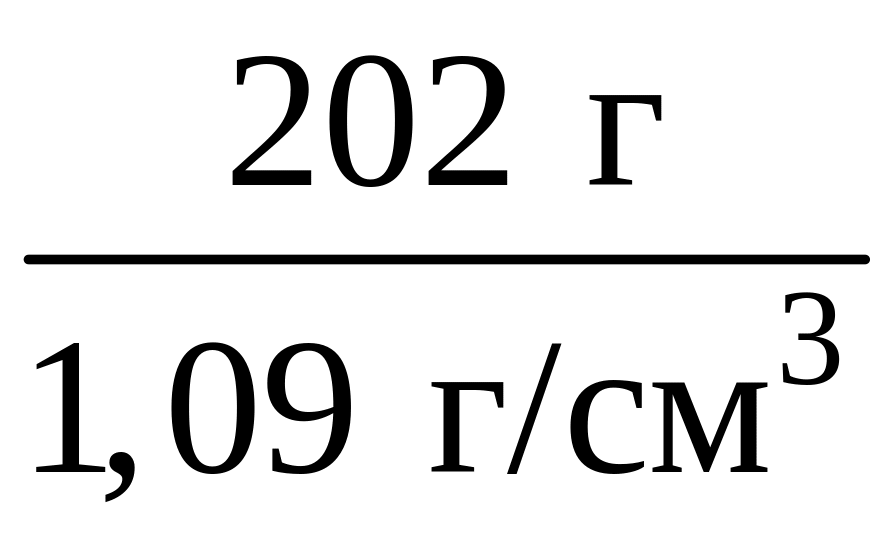 = 185 см3.
= 185 см3.
5. Найдем массу и объем добавленной воды:
m(H2O) = m(приг. р-ра) m(исх. р-ра) = 1012 202 = 810 г.
Поскольку плотность воды при комнатной температуре равна 1,0 г/см3, ее объем составит:
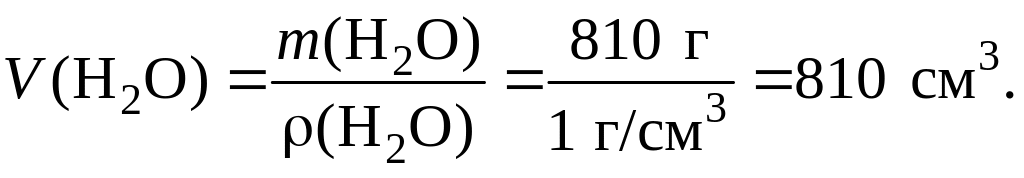
Пример 1.5.2. Рассчитайте массы воды и пентагидрата сульфата меди(II) (CuSO4 5H2O), необходимые для приготовления раствора объемом 1,0 дм3 с массовой долей CuSO4, равной 8,0 % (ρ = 1,084 г/см3).
Решение.
1. Найдем массу приготовленного раствора:
m(р-ра) = V(р-ра) (р-ра) = 1000 см3 1,084 г/см3 = 1084 г.
2. Найдем массу соли CuSO4 в этом растворе:
в растворе массой 100 г содержится CuSO4 массой 8 г,
в растворе массой 1084 г содержится CuSO4 массой х г,
![]() = 86,7 г.
= 86,7 г.
3. Вычислим массу кристаллогидрата, содержащего CuSO4 массой 86,7 г:
M(CuSO4 5H2O) = 160 г/моль + 5 18 г/моль = 250 г/моль.
В кристаллогидрате массой 250 г содержится CuSO4 массой 160 г,
в кристаллогидрате массой у г содержится CuSO4 массой 86,7 г:
![]() =135,5
г.
=135,5
г.
4. Найдем массу воды:
m(H2O) = m(приг. р-ра) – m(CuSO4 5H2O) = 1084 г 135,5 г = 948,5 г.
Пример 1.5.3. Рассчитайте объемы воды и раствора серной кислоты с массовой долей 96 % (ρ = 1,84 г/см3), необходимые для приготовления раствора H2SO4 объемом 100 см3 с массовой долей 15 % и плотностью 1,10 г/см3.
Решение.
1. Найдем массу приготовленного раствора:
m(р-ра) = V(р-ра) · ρ(р-ра) = 100 см3 1,10 г/см3 = 110 г.
2. Найдем массу кислоты в приготовленном растворе:
в растворе массой 100 г содержится H2SO4 массой 15 г,
в растворе массой 110 г содержится H2SO4 массой х г,
![]() =
16,5 г.
=
16,5 г.
3. Найдем массу исходного раствора, содержащего такую массу H2SO4:
в растворе массой 100 г содержится H2SO4 массой 96 г,
в растворе массой у г содержится H2SO4 массой 16,5 г,
![]() = 17,19 г.
= 17,19 г.
4. Вычислим объем исходного раствора:
V(р-ра) =
=

5. Вычислим массу воды, необходимую для приготовления раствора:
m(H2O) = m(приг. р-ра) – m(исх. р-ра) = 110 г – 17,19 г = 92,81 г.
6. Рассчитаем объем воды:
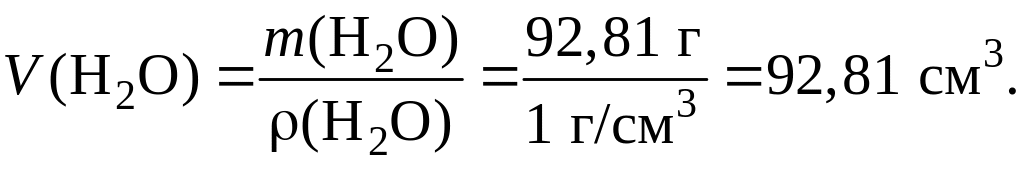
Пример 1.5.4. Какой объем раствора с массовой долей серной кислоты 80 % (ρ = 1,732 г/см3) потребуется для приготовления другого раствора объемом 250 см3, в котором молярная концентрация эквивалентов серной кислоты будет составлять 0,50 моль/дм3? Приготовленный раствор будет использован для осуществления реакции
H2SO4 + 2KOH = K2SO4 + 2H2O.
Решение.
1. Рассчитаем молярную массу эквивалентов кислоты:
Из уравнения реакции видно, сто
эквивалентом кислоты является половина
ее молекулы, т. е.
![]() Поэтому молярная масса эквивалентов
кислоты равна:
Поэтому молярная масса эквивалентов
кислоты равна:

2. Найдем химическое количество эквивалентов кислоты в приготовленном растворе:
 0,25
дм3 · 0,5 моль/дм3 =
0,25
дм3 · 0,5 моль/дм3 =
= 0,125 моль
3. Рассчитаем массу H2SO4 в приготовленном растворе:
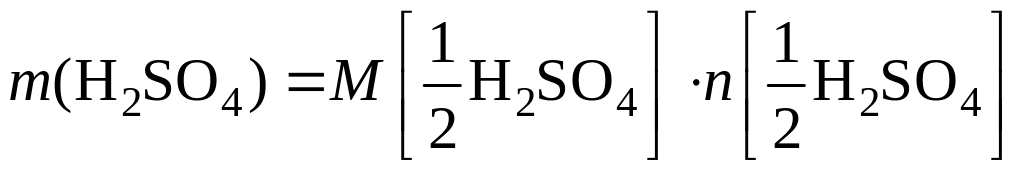 = 49 г/моль · 0,125 моль =
= 49 г/моль · 0,125 моль =
= 6,125 г.
4. Найдем массу исходного раствора, содержащего H2SO4 массой 6,125 г:
в растворе массой 100 г содержится кислота массой 80 г,
в растворе массой х г содержится кислота массой 6,125 г,
![]() = 7,66 г.
= 7,66 г.
5. Вычислим объем исходного раствора серной кислоты:
V(р-ра) =
=
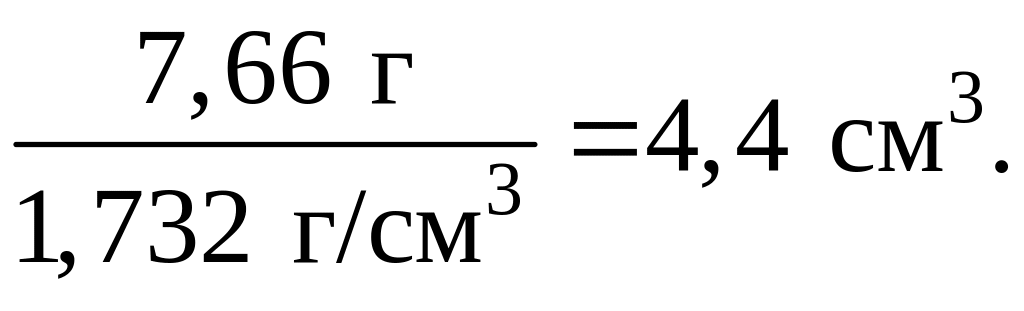
Пример 1.5.5. Насыщенный при 60 оС раствор нитрата калия массой 40 г охладили до 20 оС. Найдите массу выделившегося при этом осадка KNO3, если коэффициенты его растворимости при указанных температурах равны соответственно 110,1 и 31,6 г.
Решение.
1. Найдем массу соли в исходном насыщенном при 60 оС растворе массой 40 г:
в растворе массой (100 + 110,1) г содержится соль массой 110,1 г,
в растворе массой 40 г содержится соль массой х г,
х =

2. Найдем массу воды в этом растворе:
m(H2O) = m(р-ра) – m(KNO3) = 40 г – 20,96 г = 19,4 г.
Поскольку при охлаждении раствора в осадок выпадает безводная соль, масса воды в растворе не изменяется. Поэтому масса воды в охлажденном растворе также будет равна 19,4 г.
3. Вычислим массу KNO3, который образует насыщенный при 20 оС раствор, если масса воды равна 19,4 г:
в воде массой 100 г растворяется KNO3 массой 31,6 г,
в воде массой 19,4 г растворяется KNO3 массой y г,
![]() = 6,02 г.
= 6,02 г.
4. Найдем массу осадка соли:
Поскольку в охлажденном растворе над осадком останется соль масссой 6,02 г, масса осадка равна:
m(KNO3)↓ = 20,96 г – 6,02 г = 14,96 г.
