
- •1. Общая химия
- •1.1. Атомно-молекулярное учение. Основные понятия и законы химии
- •Закон сохранения массы веществ
- •Закон постоянства состава веществ
- •Закон эквивалентов
- •Закон эквивалентов
- •6 Ионам соответствует 1 фе Al2(so4)3,
- •1 Иону соответствует х фе Al2(so4)3,
- •Закон Авогадро
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы.
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объемам данных газов, участвующих в этих реакциях.
- •Закон Бойля – Мариотта
- •Пример 1.1.12. При некоторой температуре и давлении 98,5 кПа объем газа равен 10,4 дм3. Вычислите объем данной порции газа при той же температуре и давлении 162,6 кПа.
- •Закон Шарля – Гей-Люссака
- •Объединенный газовый закон
- •Закон парциальных давлений газов (закон Дальтона)
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.2. Основные классы неорганических соединений
- •Бинарные соединения
- •Многоэлементные соединения
- •Задачи и упражнения
- •1.3. Энергетика химических реакций
- •Возможность и условия протекания реакции при различных сочетаниях знаков rH и rS
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.4. Основы химической кинетики. Химическое равновесие Факторы, влияющие на скорость химической реакции
- •Влияние температуры на скорость химической реакции
- •Химическое равновесие
- •Влияние изменения внешних условий на положение химического равновесия. Принцип Ле Шателье
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.5. Количественный состав растворов
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.6. Равновесия в растворах электролитов
- •Константа воды (ионное произведение воды). Водородный показатель
- •Константа растворимости (произведение растворимости)
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Константа гидролиза соли Kh
- •Связь между степенью и константой гидролиза соли
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.7. Строение атома и периодический закон д. И. Менделеева Вопросы для самостоятельной подготовки
- •1.8. Химическая связь и межмолекулярное взаимодействие Вопросы для самостоятельной подготовки
- •1.9. Окислительно-восстановительные реакции
- •Важнейшие восстановители
- •Важнейшие окислители:
- •Овр межмолекулярного типа
- •Овр внутримолекулярного типа
- •Расстановка коэффициентов в уравнениях овр методом электронного баланса
- •Электродные и окислительно-восстановительные потенциалы и их использование
- •Влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •Влияние концентраций потенциалопределяющих ионов
- •Влияние величины рН раствора
- •Влияние температуры на направление протекания овр
- •Влияние величины пр малорастворимого продукта на направление протекания овр
- •Влияние комплексообразования на направление протекания овр
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.10. Комплексные соединения
- •Cтроение и состав комплексных соединений
- •Классификация комплексных соединений
- •Номенклатура комплексных соединений Названия комплексообразователей
- •Названия лигандов
- •Названия комплексных соединений
- •Диссоциация комплексных соединений в водных растворах
- •Реакции с участием комплексных ионов Реакции ионного обмена
- •Реакции лигандного обмена
- •Реакции связывания лигандов
- •Реакции осаждения комплексообразователей
- •Реакции полного восстановления комплексообразователей
- •Химическая связь в комплексных соединениях. Геометрическая форма комплексных частиц
- •Важнейшие типы гибридизации орбиталей и соответствующие им геометрические конфигурации комплексных частиц
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •2. Неорганическая химия
- •2.1. Примерная схема описания группы элементов, их атомов и образованных ими простых и сложных веществ
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •2.8. Общая характеристика d-элементов Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Приложения
- •1. Стандартные энтальпии образования и стандартные энтропии некоторых веществ при 298 k
- •2. Константы диссоциации некоторых слабых электролитов в водных растворах при 25 оС
- •3. Произведения растворимости некоторых малорастворимых электролитов при 25 оС
- •4. Константы нестойкости некоторых комплексных ионов при 25 оС
- •5. Стандартные электродные потенциалы Еo в водных растворах при 25 оС
- •Литература
- •Оглавление
Влияние температуры на скорость химической реакции
Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа: при повышении температуры на каждые 10 градусов скорость химических реакций увеличивается в 2–4 раза:
 ,
,
где
![]() –
скорости реакции соответственно при
температурах Т2 и Т1;
γ – температурный коэффициент
скорости реакции, который показывает,
во сколько раз увеличивается скорость
данной реакции при повышении температуры
на каждые 10°. Он вычисляется для каждой
реакции из экспериментальных данных и
в большинстве случаев принимает значения
от 2 до 4. При ∆Т ≤ 100 о значение
γ практически не зависит от температуры,
т. е. является для данной реакции
постоянной величиной.
–
скорости реакции соответственно при
температурах Т2 и Т1;
γ – температурный коэффициент
скорости реакции, который показывает,
во сколько раз увеличивается скорость
данной реакции при повышении температуры
на каждые 10°. Он вычисляется для каждой
реакции из экспериментальных данных и
в большинстве случаев принимает значения
от 2 до 4. При ∆Т ≤ 100 о значение
γ практически не зависит от температуры,
т. е. является для данной реакции
постоянной величиной.
С помощью правила Вант-Гоффа можно лишь примерно оценить влияние температуры на скорость реакции. Более точное описание зависимости скорости реакции от температуры осуществимо в рамках теории активации Аррениуса.
В теории активации влияние температуры и катализатора на скорость химической реакции описывается следующим уравнением для константы скорости химической реакции:
![]() ,
,
где А – постоянный множитель, не зависящий от температуры, определяющийся природой реагирующих веществ; R – молярная газовая постоянная; Еа – энергия активации реакции; е – основание натуральных логарифмов. Как следует из уравнения Аррениуса, константа скорости реакции тем больше, чем меньше энергия активации реакции.
Пример 1.4.3. Температурный коэффициент скорости химической реакции равен 2,1. Во сколько раз возрастет скорость этой реакции при увеличении температуры в реакционном сосуде от 15 оС до 38 оС?
Решение:
В соответствии с правилом Вант-Гоффа:
 ;
;
 = 5,5.
= 5,5.
Примечание. Если в вашем калькуляторе отсутствует кнопка возведения в степень, то такие арифметические вычисления можно осуществлять через стадии логарифмирования и последующего потенциирования:
 ,
а
,
а
 .
.
Химическое равновесие
Химические реакции, в результате которых исходные вещества полностью превращаются в продукты реакции, называются необратимыми. Они осуществляются только в одном направлении. Реакции, идущие одновременно в двух противоположных направлениях (прямом и обратном), называются обратимыми.
В
момент начала обратимой реакции
концентрации исходных веществ максимальны,
а концентрации продуктов реакции равны
0. С течением времени концентрации
исходных веществ и скорость прямой
реакции постепенно уменьшаются, а
концентрации продуктов и скорость
обратной реакции постепенно увеличиваются.
Однако через определенное время наступает
такое состояние системы, при котором
скорости прямой и обратной реакции
оказываются одинаковыми (![]() ).
Такое состояние называется состоянием
химического равновесия.
).
Такое состояние называется состоянием
химического равновесия.
В момент, когда устанавливается равновесие, изменение концентраций всех веществ прекращается. Концентрации веществ, находящихся в равновесной системе, называются равновесными концентрациями (ср). В общем случае для любой обратимой реакции аА + bB ↔ dD + eE , независимо от ее механизма, выполняется соотношение:
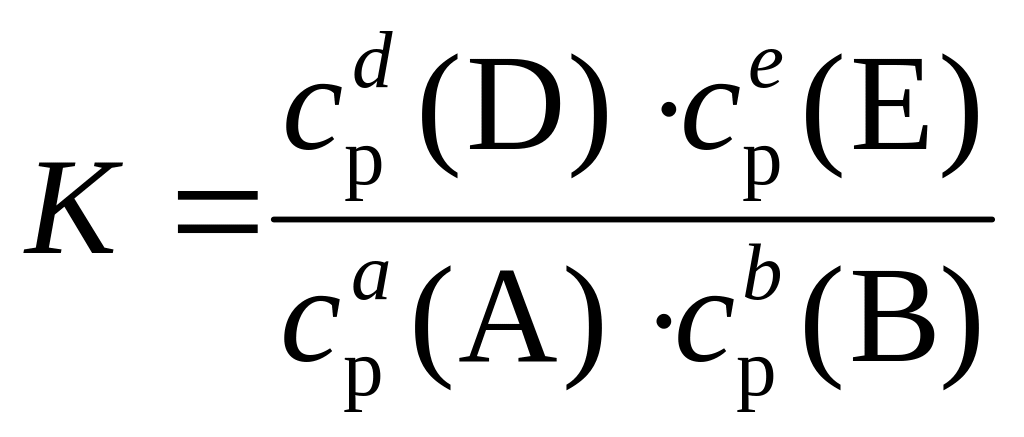 .
.
При установившемся равновесии произведение равновесных концентраций продуктов реакции, отнесенное к произведению концентраций исходных веществ, для данной реакции при данной температуре представляет собой постоянную величину, называемую константой равновесия (K).
Пример 1.4.4. Найдите величину константы химического равновесия реакции 2А (г) + В (г) ↔ 2D (г), если начальные концентрации веществ А и В были равны соответственно 0,6 моль/дм3 и 0,4 моль/дм3, а к моменту наступления равновесия количество вещества В уменьшилось на 25 %. Рассчитайте изменение давления в системе по сравнению с первоначальным, если в исходной смеси вещество D отсутствовало.
Решение.
1) Запишем выражение константы равновесия для данной реакции:
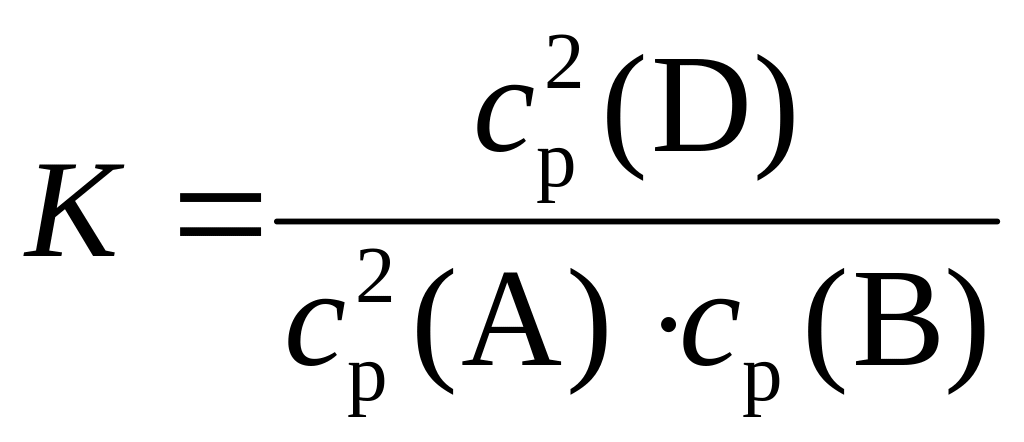 .
.
2) Определим равновесную концентрацию вещества В:
Поскольку к моменту наступления равновесия количество вещества В в системе уменьшилось на 25 %, то и его концентрация также уменьшилась на 25 %. Следовательно,
с(В) = 0,25 ∙ с0(В) = 0,25 ∙ 0,4 = 0,1 моль/дм3.
Тогда равновесная концентрация вещества В равна:
cр(В) = c0(В) – c(В) = 0,4 – 0,1 = 0,3 моль/дм3.
3) Определим равновесную концентрацию вещества А:
В соответствии с уравнением реакции c(А) = 2c(В) = 2 · 0,1 = = 0,2 моль/ дм3. Следовательно, равновесная концентрация вещества А равна: cр(А) = c0(А) – c(А) = 0,6 – 0,2 = 0,4 моль/дм3.
4) Определим равновесную концентрацию вещества D:
В соответствии с уравнением реакции количество образовавшегося вещества D равно количеству прореагировавшего вещества А, поэтому c(D) = 0,2 моль/дм3. Так как в первоначальный момент вещество D отсутствовало, то равновесная концентрация D равна:
cр(D) = 0 + c(D) = 0 + 0,2 = 0,2 моль/дм3.
5) Подставим найденные равновесные концентрации веществ А, В и D в выражение для константы равновесия и рассчитаем искомую величину K:

6) Поскольку давление в системе в начальный момент реакции (р0) и в момент наступления равновесия (р1) пропорционально суммарной концентрации газообразных веществ, можно записать:
![]() .
.
Таким образом, давление в равновесной системе будет составлять 90 % от исходной величины.
Пример 1.4.5. В системе А (г) + В (г) ↔ 2D (г) равновесные концентрации равны: cр(А) = 0,4 моль/дм3; cр(В) = 0,9 моль/дм3; cр(D) = = 0,6 моль/дм3. Найдите константу равновесия реакции и начальные концентрации (c0) веществ А и В, если вещество D в начальный момент реакции отсутствовало.
Решение.
1) Запишем выражение константы равновесия для данной реакции и рассчитаем ее величину:

2) Учитывая, что в момент начала реакции вещество D отсутствовало, найдем изменения концентраций (Δс) веществ А и В. Из уравнения реакции следует, что на образование 2 моль вещества D необходимо по 1 моль веществ А и В. Поскольку концентрация образовавшегося вещества D равна 0,6 моль/дм3, то концентрации исходных веществ А и В уменьшились на 0,3 моль/дм3, т. е. Δс(А) = Δс(В) = 0,3 моль/дм3.
3) Найдем начальные концентрации исходных веществ:
c0(А) = cр(А) + Δс(А) = 0,4 + 0,3 = 0,7 моль/дм3;
c0(В) = cр(В) + Δс(В) = 0,9 + 0,3 = 1,2 моль/дм3.
