
- •1. Общая химия
- •1.1. Атомно-молекулярное учение. Основные понятия и законы химии
- •Закон сохранения массы веществ
- •Закон постоянства состава веществ
- •Закон эквивалентов
- •Закон эквивалентов
- •6 Ионам соответствует 1 фе Al2(so4)3,
- •1 Иону соответствует х фе Al2(so4)3,
- •Закон Авогадро
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы.
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объемам данных газов, участвующих в этих реакциях.
- •Закон Бойля – Мариотта
- •Пример 1.1.12. При некоторой температуре и давлении 98,5 кПа объем газа равен 10,4 дм3. Вычислите объем данной порции газа при той же температуре и давлении 162,6 кПа.
- •Закон Шарля – Гей-Люссака
- •Объединенный газовый закон
- •Закон парциальных давлений газов (закон Дальтона)
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.2. Основные классы неорганических соединений
- •Бинарные соединения
- •Многоэлементные соединения
- •Задачи и упражнения
- •1.3. Энергетика химических реакций
- •Возможность и условия протекания реакции при различных сочетаниях знаков rH и rS
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.4. Основы химической кинетики. Химическое равновесие Факторы, влияющие на скорость химической реакции
- •Влияние температуры на скорость химической реакции
- •Химическое равновесие
- •Влияние изменения внешних условий на положение химического равновесия. Принцип Ле Шателье
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.5. Количественный состав растворов
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.6. Равновесия в растворах электролитов
- •Константа воды (ионное произведение воды). Водородный показатель
- •Константа растворимости (произведение растворимости)
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Константа гидролиза соли Kh
- •Связь между степенью и константой гидролиза соли
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.7. Строение атома и периодический закон д. И. Менделеева Вопросы для самостоятельной подготовки
- •1.8. Химическая связь и межмолекулярное взаимодействие Вопросы для самостоятельной подготовки
- •1.9. Окислительно-восстановительные реакции
- •Важнейшие восстановители
- •Важнейшие окислители:
- •Овр межмолекулярного типа
- •Овр внутримолекулярного типа
- •Расстановка коэффициентов в уравнениях овр методом электронного баланса
- •Электродные и окислительно-восстановительные потенциалы и их использование
- •Влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •Влияние концентраций потенциалопределяющих ионов
- •Влияние величины рН раствора
- •Влияние температуры на направление протекания овр
- •Влияние величины пр малорастворимого продукта на направление протекания овр
- •Влияние комплексообразования на направление протекания овр
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.10. Комплексные соединения
- •Cтроение и состав комплексных соединений
- •Классификация комплексных соединений
- •Номенклатура комплексных соединений Названия комплексообразователей
- •Названия лигандов
- •Названия комплексных соединений
- •Диссоциация комплексных соединений в водных растворах
- •Реакции с участием комплексных ионов Реакции ионного обмена
- •Реакции лигандного обмена
- •Реакции связывания лигандов
- •Реакции осаждения комплексообразователей
- •Реакции полного восстановления комплексообразователей
- •Химическая связь в комплексных соединениях. Геометрическая форма комплексных частиц
- •Важнейшие типы гибридизации орбиталей и соответствующие им геометрические конфигурации комплексных частиц
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •2. Неорганическая химия
- •2.1. Примерная схема описания группы элементов, их атомов и образованных ими простых и сложных веществ
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •2.8. Общая характеристика d-элементов Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Приложения
- •1. Стандартные энтальпии образования и стандартные энтропии некоторых веществ при 298 k
- •2. Константы диссоциации некоторых слабых электролитов в водных растворах при 25 оС
- •3. Произведения растворимости некоторых малорастворимых электролитов при 25 оС
- •4. Константы нестойкости некоторых комплексных ионов при 25 оС
- •5. Стандартные электродные потенциалы Еo в водных растворах при 25 оС
- •Литература
- •Оглавление
1.4. Основы химической кинетики. Химическое равновесие Факторы, влияющие на скорость химической реакции
Скорость гомогенной реакции – это величина, численно равная изменению молярной концентрации любого из веществ, участвующих в реакции в единицу времени.
Средняя скорость реакции vср в интервале времени от t1 до t2 определяется соотношением:
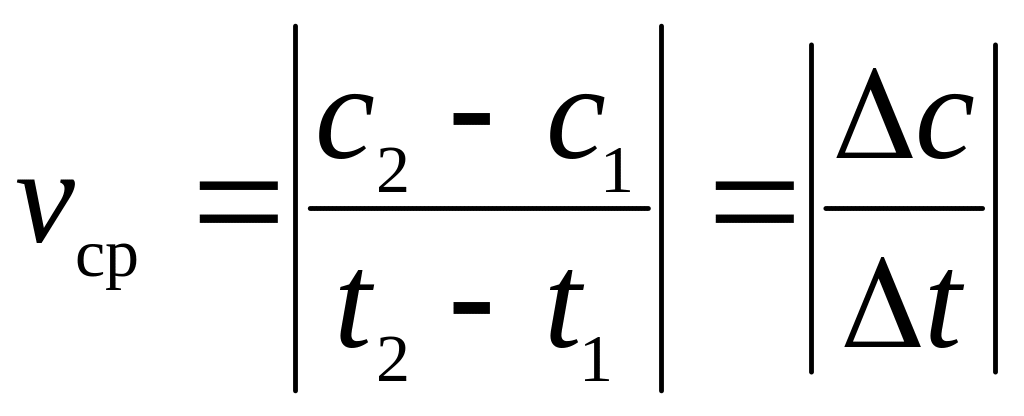 .
.
Основные факторы, влияющие на скорость гомогенной химической реакции:
природа (состав и строение) реагирующих веществ;
концентрации реагентов;
давление (если в реакции участвуют газы);
температура;
наличие катализатора.
Все химические реакции по стадийности подразделяются на элементарные (одностадийные) и сложные (многостадийные). Большинство химических реакций представляет собой сложные процессы, протекающие в несколько стадий, т. е. состоящие из нескольких элементарных процессов.
Для элементарных реакций справедлив закон действующих масс: скорость химической реакции при данной температуре прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных соответствующим стехиометрическим коэффициентам.
Для элементарной реакции аА + bB → ... ее скорость согласно закону действующих масс выражается уравнением:
![]() ,
,
где с(А) и с(В) — молярные концентрации реагирующих веществ А и В; k – константа скорости данной реакции. Физический смысл константы скорости: она численно равна скорости химической реакции при концентрациях реагентов c(А) и c(В) = 1 моль/дм3. Величина константы скорости гомогенной реакции зависит от природы реагирующих веществ, температуры и наличия катализатора.
Большинство химических реакций являются сложными, протекающими через множество промежуточных стадий. В таком случае закон действующих масс применим только к каждой отдельной стадии, а скорость реакции в целом определяется скоростью самой медленной уу стадии.
В случае гетерогенных реакций в уравнение
закона действующих масс входят
концентрации не всех реагентов, а только
газообразных или растворенных.
Так, для реакции горения угля С (к)
+ О2 (г) → СО2 (г) уравнение
скорости имеет вид
![]() .
.
Пример 1.4.1. Константа скорости реакции 2NO (г) + O2 (г) → 2NO2 (г) при некоторой температуре равна 0,8. Рассчитайте:
а) начальную скорость реакции, если начальные концентрации реагирующих веществ равны: c0(NO) = 0,4 моль/дм3, c0(O2) = 0,3 моль/дм3;
б) скорость этой реакции в момент, когда количество NO в системе уменьшится на 25 %.
Решение.
1) Рассчитаем скорость данной реакции в первоначальный момент (v0), подставив в выражение закона действующих масс начальные концентрации (c0) веществ:
![]() моль/(дм3
∙ с).
моль/(дм3
∙ с).
2) Найдем изменение концентрации оксида азота(II) Δc(NO):
Поскольку количество NO уменьшилось на 25 %, то и его концентрация также уменьшилась на 25 %. Поэтому:
Δc(NO) = 0,25 ∙ c0(NO) = 0,25 ∙ 0,4 моль/дм3 = 0,1 моль/дм3.
3) Из уравнения реакции найдём соответствующее изменение концентрации кислорода:
Δc(O2) = Δc(NO) : 2 = 0,1 : 2 = 0,05 моль/дм3.
4) Найдем новые концентрации (с1) реагирующих веществ:
с1(NO) = с0(NO) – Δc(NO) = 0,4 – 0,1 = 0,3 моль/дм3;
с1(O2) = с0(O2) – Δc(O2) = 0,3 – 0,05 = 0,25 моль/дм3.
5) Рассчитаем новое значение скорости реакции:
![]() моль/(дм3
∙ с).
моль/(дм3
∙ с).
Пример 1.4.2. Как изменится скорость реакции
2NO (г) + Cl2 (г) → 2NOCl (г), если:
а) увеличить давление в реакционном сосуде в 2 раза;
б) уменьшить объем сосуда в 4 раза?
Решение.
1) Обозначив начальные концентрации NO и Cl2 как с0(NO) и с0(Cl2), запишем выражение для скорости реакции в начальный её момент:
![]()
2) Поскольку давление в системе увеличивается в 2 раза, концентрации всех газообразных веществ в ней также увеличиваются в 2 раза и составляют:
c1(NO) = 2c0(NO), c1(Cl2) = 2c0(Cl2).
3) Учитывая, что константа скорости реакции k при увеличении давления не изменяется, подставим найденные новые значения концентраций c1(NO) и c1(Cl2) в выражение закона действующих масс:
![]() =
=
![]() =
=
= 8 · k · c02(NO) · c0(Cl2).
4) Найдем, во сколько раз v1 больше v0:
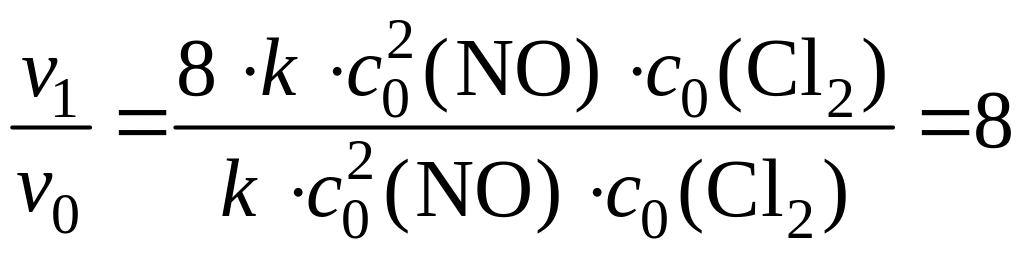 .
.
Следовательно, при увеличении давления в системе в 2 раза скорость реакции увеличится в 8 раз.
5) Поскольку при уменьшении объема сосуда в 4 раза концентрации всех содержащихся в нем газов увеличиваются в 4 раза, новые концентрации NO и Cl2 будут равны:
c1(NO) = 4·c0(NO), a c1(Cl2) = 4·c0(Cl2).
6)
Выполнив подстановку и расчеты, как в
пунктах 3 и 4, получим
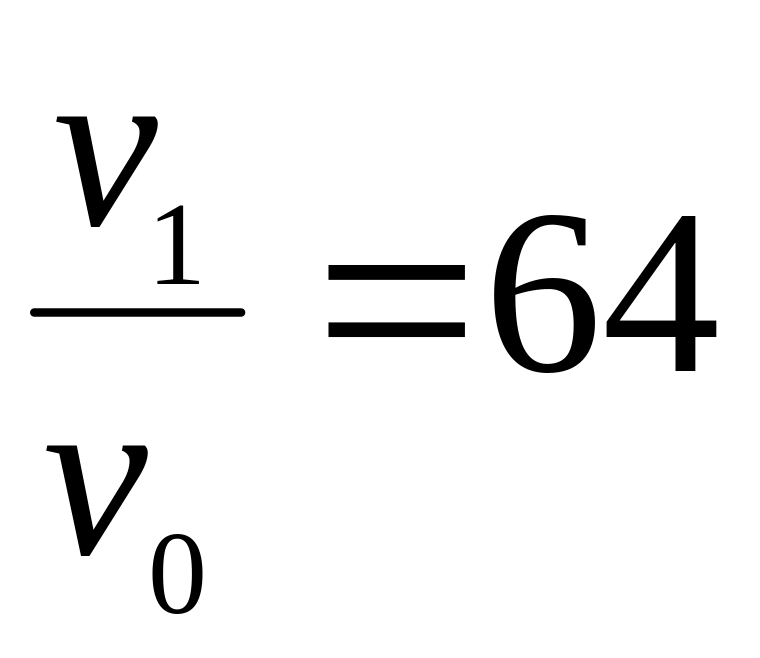 ,
т. е. уменьшение объема сосуда в 4 раза
приведет к увеличению скорости реакции
в 64 раза.
,
т. е. уменьшение объема сосуда в 4 раза
приведет к увеличению скорости реакции
в 64 раза.
