
- •1. Общая химия
- •1.1. Атомно-молекулярное учение. Основные понятия и законы химии
- •Закон сохранения массы веществ
- •Закон постоянства состава веществ
- •Закон эквивалентов
- •Закон эквивалентов
- •6 Ионам соответствует 1 фе Al2(so4)3,
- •1 Иону соответствует х фе Al2(so4)3,
- •Закон Авогадро
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы.
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объемам данных газов, участвующих в этих реакциях.
- •Закон Бойля – Мариотта
- •Пример 1.1.12. При некоторой температуре и давлении 98,5 кПа объем газа равен 10,4 дм3. Вычислите объем данной порции газа при той же температуре и давлении 162,6 кПа.
- •Закон Шарля – Гей-Люссака
- •Объединенный газовый закон
- •Закон парциальных давлений газов (закон Дальтона)
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.2. Основные классы неорганических соединений
- •Бинарные соединения
- •Многоэлементные соединения
- •Задачи и упражнения
- •1.3. Энергетика химических реакций
- •Возможность и условия протекания реакции при различных сочетаниях знаков rH и rS
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.4. Основы химической кинетики. Химическое равновесие Факторы, влияющие на скорость химической реакции
- •Влияние температуры на скорость химической реакции
- •Химическое равновесие
- •Влияние изменения внешних условий на положение химического равновесия. Принцип Ле Шателье
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.5. Количественный состав растворов
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.6. Равновесия в растворах электролитов
- •Константа воды (ионное произведение воды). Водородный показатель
- •Константа растворимости (произведение растворимости)
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Константа гидролиза соли Kh
- •Связь между степенью и константой гидролиза соли
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.7. Строение атома и периодический закон д. И. Менделеева Вопросы для самостоятельной подготовки
- •1.8. Химическая связь и межмолекулярное взаимодействие Вопросы для самостоятельной подготовки
- •1.9. Окислительно-восстановительные реакции
- •Важнейшие восстановители
- •Важнейшие окислители:
- •Овр межмолекулярного типа
- •Овр внутримолекулярного типа
- •Расстановка коэффициентов в уравнениях овр методом электронного баланса
- •Электродные и окислительно-восстановительные потенциалы и их использование
- •Влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •Влияние концентраций потенциалопределяющих ионов
- •Влияние величины рН раствора
- •Влияние температуры на направление протекания овр
- •Влияние величины пр малорастворимого продукта на направление протекания овр
- •Влияние комплексообразования на направление протекания овр
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •1.10. Комплексные соединения
- •Cтроение и состав комплексных соединений
- •Классификация комплексных соединений
- •Номенклатура комплексных соединений Названия комплексообразователей
- •Названия лигандов
- •Названия комплексных соединений
- •Диссоциация комплексных соединений в водных растворах
- •Реакции с участием комплексных ионов Реакции ионного обмена
- •Реакции лигандного обмена
- •Реакции связывания лигандов
- •Реакции осаждения комплексообразователей
- •Реакции полного восстановления комплексообразователей
- •Химическая связь в комплексных соединениях. Геометрическая форма комплексных частиц
- •Важнейшие типы гибридизации орбиталей и соответствующие им геометрические конфигурации комплексных частиц
- •Вопросы для самостоятельной подготовки
- •Задачи и упражнения
- •2. Неорганическая химия
- •2.1. Примерная схема описания группы элементов, их атомов и образованных ими простых и сложных веществ
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •2.8. Общая характеристика d-элементов Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Вопросы для самостоятельной подготовки
- •Приложения
- •1. Стандартные энтальпии образования и стандартные энтропии некоторых веществ при 298 k
- •2. Константы диссоциации некоторых слабых электролитов в водных растворах при 25 оС
- •3. Произведения растворимости некоторых малорастворимых электролитов при 25 оС
- •4. Константы нестойкости некоторых комплексных ионов при 25 оС
- •5. Стандартные электродные потенциалы Еo в водных растворах при 25 оС
- •Литература
- •Оглавление
1. Общая химия
1.1. Атомно-молекулярное учение. Основные понятия и законы химии
К важнейшим понятиям, составляющим основу атомно-молекуляр-ного учения, относятся: атомная частица, атом, атомный ион, химический элемент, молекулярная частица, молекула, молекулярный ион, относительная атомная масса, относительная молекулярная масса, формульная единица, относительная формульная масса, вещество, химическое количество вещества, моль, молярная масса.
Атомная частица (а. ч.) – мельчайшая, химически неделимая частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Следует различать электронейтральные а. ч. – атомы и заряженные а. ч. – атомные ионы.
Атом
–
мельчайшая,
электронейтральная, химически неделимая
частица, состоящая из положительно
заряженного ядра и отрицательно
заряженных электронов.
Примеры атомов:
![]()
Атомный
ион –
мельчайшая,
заряженная, химически неделимая частица,
состоящая из положительно заряженного
ядра и отрицательно заряженных электронов.
Примеры атомных ионов:
![]()
Общий признак а. ч. – наличие в них одного ядра.
Химический элемент – вид атомных частиц с одинаковым зарядом ядер (с одинаковым протонным числом). Каждый химический элемент имеет свое название и символ. В настоящее время известны 117 химических элементов.
Молекулярная частица – мельчайшая, химически делимая частица, состоящая из нескольких атомных частиц. Различают незаряженные молекулярные частицы (молекулы и молекулярные радикалы) и заряженные – молекулярные ионы.
Молекула – мельчайшая, способная к самостоятельному существованию электронейтральная частица, сохраняющая все химические свойства данного вещества. Молекулы могут состоять из атомных частиц одного или нескольких элементов, например: О2, Р4, S8, H2O, C6H6, SF4, HNO3, Si(OC2H5)4. Молекулы являются носителями состава и химических свойств образованных ими веществ. Размеры и массы молекул также чрезвычайно малы. Например, масса одной молекулы воды равна 2,9926 · 10–26 кг.
Молекулярный
радикал
–
молекулярная
частица с неспаренным электроном.
Примеры:
![]() ,
,
![]() ,
,
![]() (неспаренные
электроны обозначены точками над
символами элементов). Как правило,
молекулярные радикалы обладают высокой
химической активностью и в большинстве
случаев не могут существовать в свободном
состоянии.
(неспаренные
электроны обозначены точками над
символами элементов). Как правило,
молекулярные радикалы обладают высокой
химической активностью и в большинстве
случаев не могут существовать в свободном
состоянии.
Молекулярный
ион –
молекулярная
частица, обладающая электрическим
зарядом.
Различают молекулярные катионы и
молекулярные анионы, например:
![]() и
и
![]() .
.
Постоянная
атомной массы
– mu
(u)
–
физическая
величина, численно равная одной
двенадцатой массы атома нуклида
![]() :
:
 .
.
Раньше эту величину называли «атомная единица массы» (а. е. м) или «углеродная единица» (у. е.). В биологической литературе встречается еще одно устаревшее название этой величины – «Дальтон» (Dа).
Относительная атомная масса элемента – Ar(Х) – величина, равная отношению средней массы атомных частиц данного элемента к постоянной атомной массы mu:

Например, относительная атомная масса кальция составляет:
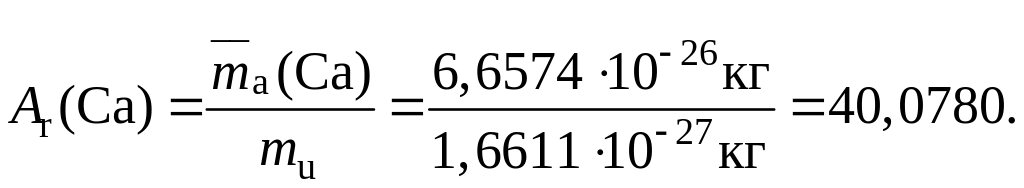
Относительная молекулярная масса – Mr(Х) – величина, равная отношению средней массы молекул вещества Х к постоянной атомной массы mu:
Mr(Х) =

Например, относительная молекулярная масса воды составляет:
Mr(H2O) =

Значение относительной молекулярной массы можно найти, исходя из значений относительных атомных масс элементов, например:
Mr(H2O) = 2 ∙ Ar(H) + Ar(O) = 2 ∙ 1,0079 + 15,9994 = 18,0152.
Вещество – устойчивая совокупность частиц (атомов, ионов или молекул), обладающая определенными химическими и физическими свойствами.
В настоящее время известно более 45 миллионов индивидуальных веществ. Подавляющее большинство из них (~ 98 %) относится к органическим веществам, остальные – к неорганическим.
В зависимости от числа химических элементов, образующих вещества, последние делятся на простые и сложные. Простое вещество образовано атомами одного элемента, сложное – атомами разных элементов. Известно около 550 простых веществ, что намного больше числа известных элементов. Причина этого в том, что некоторым элементам соответствует по нескольку простых веществ. Такое явление называется аллотрóпией, а сами простые вещества, образованные атомами одного элемента, – его аллотропными модификациями.
При определенных условиях вещества могут находиться в трех агрегатных состояниях – газообразном, жидком и твердом (аморфном или кристаллическом).
Для описания пространственного строения любого твердого кристаллического вещества используется понятие «кристаллическая решетка».
Кристаллическая решетка вещества – пространственная модель его кристалла. Она представляет собой условный каркас, в узлах которого находятся молекулы, атомы или ионы, образующие данное вещество.
В зависимости от природы частиц, образующих вещества, различают 4 основных типа кристаллических решеток – молекулярные, атомные, ионные и металлические. Вещества с молекулярным типом кристаллической решетки относятся к веществам молекулярного строения, а вещества с тремя другими типами решеток – к веществам немолекулярного строения.
Вещества молекулярного строения обладают низкими температурами плавления (обычно до 300 оС). Они летучи и часто обладают запахом. К ним относятся все газообразные или жидкие при комнатной температуре вещества, а также некоторые легкоплавкие твердые вещества (парафин, белый фосфор, ромбическая сера, фенол, сахароза и др.).
Вещества немолекулярного строения характеризуются высокими температурами плавления (обычно выше 300 оС). При комнатной температуре они находятся только в твердом агрегатном состоянии, практически нелетучи и поэтому не обладают запахом. Атомное строение присуще кристаллам некоторых простых веществ-неметаллов – бора, углерода, кремния, фосфора и других. Ионное строение характерно почти для всех соединений щелочных и щелочноземельных металлов, магния, а также для всех солей аммония.
Важнейшей характеристикой любого сложного вещества является его качественный и количественный состав, выражающийся с помощью химических формул.
Химическая формула – графическое изображение состава и (или) строения вещества с помощью символов химических элементов и математических знаков (цифр, скобок, штрихов, точек).
Различают несколько типов химических формул.
Стехиометрические формулы (формулы состава) отражают качественный и количественный состав веществ с помощью символов химических элементов, цифр, скобок и точек, например: C6H12O6, (NH4)2CO3, CuSO4 ∙ 5H2O. Различают простейшие (эмпирические) и молекулярные стехиометрические формулы, например, СH2O и С6Н12О6.
Структурные формулы (формулы строения) отображают порядок (последовательность) соединения атомов в молекулах или в атомных кристаллах с помощью символов элементов, штрихов и цифр. Различают сокращенные и развернутые структурные (графические) формулы.
Формульная единица вещества (ФЕ) – реальная или условная частица вещества, состав которой определяет его химическую формулу.
К реальным формульным единицам относятся молекулы (в случае веществ молекулярного строения) и атомы (в случае простых веществ атомного строения). Например, формульной единицей воды является ее молекула – H2O, формульной единицей кремния – его атом – Si.
К условным формульным единицам относят группы атомов или ионов, входящих в состав сложных веществ немолекулярного строения.
Если вещество немолекулярного строения состоит из атомов нескольких элементов, например SiO2, его формульной единицей является условная частица, состоящая из одного атома Si и двух атомов О. Она является условной потому, что в кристалле оксида кремния(IV) нет отдельных молекул SiO2, он состоит из множества атомов кремния и кислорода. Но весь кристалл можно условно разделить на группы атомов, в каждой из которых будет один атом Si и два атома О. Таким образом, формульная единица оксида кремния(IV) – условная, реально не существующая частица «SiO2».
Если вещество немолекулярного строения состоит из ионов, например NaCl, его формульной единицей является условная частица, состоящая из одного иона Na+ и одного иона Clˉ. Она является условной потому, что в кристалле хлорида натрия нет молекул NaCl, так как он состоит из ионов. Но весь этот кристалл можно условно разделить на группы ионов, в каждой из которых будет один ион Na+ и один ион Clˉ. Следовательно, формульной единицей хлорида натрия является условная частица, состоящая из двух ионов.
К сложным веществам немолекулярного строения нельзя применять понятие «относительная молекулярная масса». Поскольку структурными единицами таких веществ являются не молекулы, а условные формульные единицы, к ним применим термин «относительная формульная масса».
Относительная формульная масса – Mf,r(X) – величина, равная отношению массы одной формульной единицы вещества Х к постоянной атомной массы.
Значение Mf,r равно сумме значений Ar элементов с учетом числа их атомов в формульной единице.
Химическое количество вещества – n(X) – величина, равная отношению числа ФЕ данного вещества Х к постоянной Авогадро (NA):
 .
.
Единица химического количества вещества – моль. Установлено, что любое вещество химическим количеством 1 моль всегда содержит 6,02∙1023 его ФЕ. Число 6,02∙1023 называется числом Авогадро. Это число, отнесенное к 1 моль, называется постоянной Авогадро и обозначается символом NA:

Физический смысл химического количества вещества: числовое значение n показывает, во сколько раз число ФЕ вещества в данной его порции больше числа Авогадро.
Молярная масса вещества – М – физическая величина, равная отношению массы данного вещества Х к его химическому количеству:

Единица молярной массы – г/моль.
Физический смысл молярной массы: она численно равна массе вещества, взятого в количестве 1 моль.
Числовые значения молярных масс простых и сложных веществ молекулярного строения совпадают с соответствующими значениями их относительных молекулярных масс, например: Мr(Р4) = 123,896 и М(Р4) = 123,896 г/моль; Мr(Н2О) = 18,015 и М(Н2О) = 18,015 г/моль.
Значения молярных масс простых и сложных веществ немолекулярного строения численно равны соответствующим значениям относительных атомных или относительных формульных масс, например: Ar(Si) = 28,085 и М(Si) = 28,085 г/моль; Mf,r(CuSO4∙5H2O) = 249,681 и M(CuSO4∙5H2O) = 249,681 г/моль.
Молярный объем вещества – Vm – физическая величина, численно равная отношению объема данного вещества Х к его химическому количеству:

Единицы молярного объема: см3/моль; дм3/моль; м3/моль. Например, Vm(CO2)(н. у.) = 22,392 дм3/моль; Vm(Fe) = 7,086 см3/моль.
Химическое количество вещества, его масса, объем (для газов) и число ФЕ связаны между собой соотношением
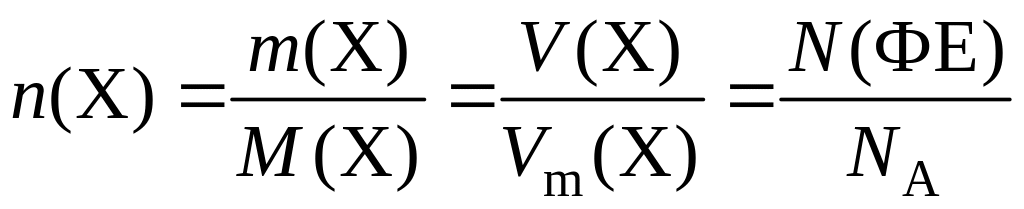 .
.
К важнейшим законам химии относятся закон сохранения массы вещества, закон постоянства состава вещества, закон химических эквивалентов и законы газового состояния.
