
- •Дофаминовые рецепторы
- •3.4. Классификация дофаминовых рецепторов
- •3.4. Классификация дофаминовых рецепторов
- •3.5. Эффекторные системы дофаминовых рецепторов
- •Гипотетическая модель связывания агонистов и антагонистов с дофаминовыми рецепторами передней доли гипофиза свиней
- •3.6. Солюбилизация ______дофаминовых рецепторов_____
- •3.7. Молекулярные механизмы
- •3.8. Дофаминовые рецепторы сердечно-сосудистой системы____
- •3.12. Дофаминовые ________рецепторы надпочечников
- •3.13. Дофаминовые рецепторы — _______мишень действия лв_________
Дофаминовые рецепторы
Первое сообщение о синтезе предшественника норадреналина - дофамина - было сделано одновременно и независимо друг от друга G.Barger, P.C.Ewins (1910) и E.Mannich, W.Jacobsohn (1910), которые выяснили, что дофамин обладает слабой периферической симпатомиметической активностью. Затем было установлено, что дофамин изменяет функции сердечно-сосудистой системы совершенно отличные от тех, которые вызывают адреналин или норадреналин.
В 1942 г. P.Holtz и Credner обнаружили, что дофамин снижает артериальное давление у морских свинок и кроликов. В то время еще не были синтезированы специфические b-адреноблокаторы, поэтому нельзя было выяснить, обусловлен ли данный эффект дофамина его взаимодействием с b-адрепорецепторами или какими-либо другими рецепторами. Лишь недавно в условиях полной блокады a- и b-адренорецепторов удалось точно установить избирательное опосредование дофаминовыми рецепторами метаболических и сердечно-сосудистых эффектов дофамипа [Seeman P., 1982].
Еще раньше биохимическими методами было показано присутствие дофамина в головном мозге млекопитающих [Montagu К.А., 1957; Weil-Malherbe H., Bone A.D., 1957; Carlsson A. et al., 1958]. С помощью гистохимических методик A.Carlsson и соавт. (1962) выявили локализацию дофамина в межнейрональном пространстве, что дало возможность предположить существование дофаминергических нейрональных систем по аналогии с адренергическими и холинергическими системами.
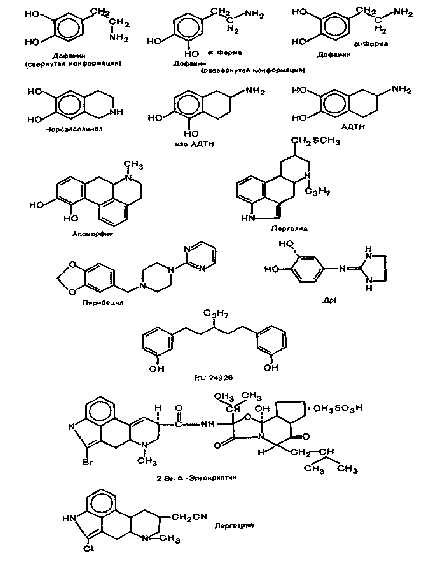
Стимулом к поиску агонистов дофаминовых рецепторов были исследования H. Ehringer и O.Hornykiewicz (1960), которые установили очень сильное снижение содержания дофамина в полосатом теле головного мозга больных, страдающих болезнью Паркинсона. Логично было предположить, что дофаминергические вещества можно будет использовать в качестве противопаркинсонических средств. Первым агонистом дофаминовых рецепторов, кроме самого дофамина, стал аноморфин. Проведенные исследования A.M.Ernst (1965) показали, что поведенческие эффекты аноморфина опосредованы стимуляцией центральных дофаминовых рецепторов. В последующих исследованиях была выявлена агонистическая активность аноморфина в отношении дофаминовых рецепторов. В настоящее время все дофаминергические вещества разделяют на агонисты и антагонисты.
3.1. Агонисты дофаминовых рецепторов
Агописты дофаминовых рецепторов разделяют на прямые и непрямые.
3.1.1. Дофаминовые агонисты прямого типа действия Агоиисты этого типа взаимодействуют не только с дофами-повыми рецепторами: аминотетралип и аиоморфип стимулируют также а-адреиореценторы. Это не удивительно, так как сам дофамин активен но отношению к а- и р-адренореценторам.
3.1.2. Дофаминовые агонисты непрямого типа действия Данные вещества вызывают высвобождение дофамипа (и норадреиалина) из пеграиулярного резерпииоустойчивого пула (амфетамин, 1-эфедрин) или из гранулярного и пеграну-лярпого пулов (метилфенидат, мазипфеп), а также блокируют обратный захват дофамипа (иомифензии, бепзотрошш).
3.2. Антагонисты дофаминовых
рецепторов_____________
Эти1 соединения представлены аптипсихотическими средствами: производными феиотиазииа (хлорпромазин, иерфеиа-зип), бутирофенона (гиалонеридол), дифеиибутилшшеридииа (иимозид), тиоксаптепа (флупеитиксол), дибепзодиазепииа (кло-запип) и беизамида (сулышрид, метохлорпрамид). Отметим, что некоторые дофамиповые антагонисты блокируют также ос-адренергические, холипергические, серотонипергические и гис-таминергические рецепторы.
3.3. Фармако-биохимический анализ ______дофаминовых рецепторов______
Для изучения дофамиповых рецепторов полезным оказалось использовать препарат изолированного головного мозга змеи Helix aspersu и применение внутриклеточных микроэлектродов. Именно таким путем было доказано взаимодействие алкалоидов спорыньи с дофамииовыми рецепторами. Выяснено, что эргометрин и диэтиламид лизершповой кислоты подавляют ингибирующее действие дофамипа па нейроны Helix aspersu [Walker RJ. et al., 1968; Woodruff G.N., 1971].
Позднее были разработаны электрофизиологические методы изучения активности нейронов млекопитающих, что позволило выявить депрессивное действие иопофоретически вводимого дофамипа па электрическую активность нейронов хвостатого ядра и accumbens головного мозга крыс [Conzalez-VegaJ.A., 1974; Siggins G.R. et al., 1974; Woodruff G.N. et al., 1976]. Данный эффект дофамипа блокировали нейролеп-тиками [Gonzalez-Vegas J.A., 1970; McCarthly P.S. et al., 1977; Bunney B.S., 1979].
Для оценки функциональной активности дофамиповых рецепторов ЦНС были разработаны также поведенческие тесты. Наибольшее распространение получила 6-оксидофамиио-вая вращательная модель, предложенная U.Ungerstedt (1971). Суть данного теста заключается в одностороннем разрушении иигростриатного пути с помощью локального введения 6-оксидофамипа в черную субстанцию. Если через несколько дней этим животным ввести аноморфии, то животные начинают вращаться в сторону, противоположную от полушария, в котором был разрушен нигростриатный путь (т.е. возникает стереотипия поведения). Эффект, аналогичный апоморфипу, дают также эргометрии, бромкрентин [Carrodi H. et al., 1973; Pijnenburg A.J.,1973; Woodruff G.N., 1974],2-амшю-6,7-1,2,3,4-тетраиафталеи (АДТН) [Woodruff G.N., Sunners С., 1979].
Эргометрин при его микроионофоретическом введении в хвостатое ядро и accumbens крыс вызывает дофамииоподоб-пый эффект [Woodruff G.H. et al., 1978].
Кроме того, можно оценивать фармакологическую активность дофамииергических веществ по двигательному тесту.
Пресииаптические дофамиповые рецепторы, или аутореце-пторы, изучают также с помощью электрофизиологического метода. Дофамипергические нейроны компактной зоны черной субстанции идентифицируют но изменению их электрической активности в ответ на внутривенное введение ацоморфина и других агонистов и антагонистов дофаминовых рецепторов [Guyenet P.C., Aghajanian O.K., 1978; Bunney B.S., 1979], если они проходят через гематоэпцефалический барьер. Дофамипо-вые аутореценторы модулируют высвобождение и синтез до-фамипа [Carlssgon А., 1975; Bunney В.S., 1979; Haubrich D.R., Pflueger A.B., 1982]. Выявлено, что стимуляция нресипаптиче-ских дофамииовых рецепторов сопровождается иигибировани-ем высвобождения дофамипа из дофамипергических нервов.
Дофаминовые рецепторы, расположенные на холинергичес-ких нейронах, опосредуют модулирующее влияние дофамина па высвобождение ацетилхолииа [Cubeddu Z.X., Hoffman I.S., 1983].
Обнаружено, что двигательную стимуляцию вызывают до-фаминовые агописты: эргометрип [Pijnenburg A.J. et al.,1973], АДТН [Elkhawad A.O., Woodruff G.N., 1975; Woodruff G.N., Andrews C.D., 1979], а также амфетамин, стимулирующий высвобождение эндогенного дофамина [Taylor К.A., Snyder S.H., 1971]. Позднее было установлено, что данный эффект агонистов дофамипа обусловлен их влиянием на центральные дофа-мииергические системы. Показано, что двустороннее введение в ядро accumbens крыс эргометрипа и АДТН приводит к продолжительному увеличению у них двигательной активности [Pijnenburg A.J., 1973; Elkhawad A.O., Woodruff G.N., 1975; Woodruff G.N., Andrews C.D., 1979]. Данный стимулирующий
эффект АДТН избирательно блокируется при впутрибрюшин-ном введении крысам низких доз флупеитиксола, флуфепази-па, или галоиеридо:a [Elkhawad А.О., Woodruff G.N., 1975; Woodruff G.H., Andrews C.D., 1978]. Сулышрид подавлял этот эффект АДТН в относительно высокой дозе (20 мг/кг) [Woodruff G.H., Andrews C.D., 1979], что может быть связано с его слабым проникновением в головной мозг. При непосредственном введении сулышрида в ядро accumbens on блокировал эффект АДТН в дозе 1 мкг.
Активность S-( — )-сулышрида в этом отношении была в 25 раз выше, чем К-(+)-сулышрида [Andrews C.D., Woodruff G.H., 1978].
Одним из основных способов прямого изучения локализации и характеристик дофаминовых рецепторов в настоящее время является метод исследования связывания меченных тритием лигапдов с этими рецепторами. В качестве таких ра-диолигандов используют антагонисты: 3Н-галоперидол [Creeese I. et al., 1975; Seeman P., 1975], 3Н-снироперидол [Leysen J.E. et al., 1978], 3Н-цис (г)-флунептиксол [Hyttel J., 1980], 3Н-домперидон [Baudry M. et al., 1979], 3Н-сулыш-pHu[TheodoronA.E., 1979;FreedmanS.B., Woodruff G.N., 1981;
метода. Дофамипергические нейроны компактной зоны черной субстанции идентифицируют но изменению их электрической активности в ответ на внутривенное введение ацоморфина и других агонистов и антагонистов дофаминовых рецепторов [Guyenet P.C., Aghajanian O.K., 1978; Bunney B.S., 1979], если они проходят через гематоэпцефалический барьер. Дофамипо-вые аутореценторы модулируют высвобождение и синтез до-фамипа [Carlssgon А., 1975; Bunney В.S., 1979; Haubrich D.R., Pflueger A.B., 1982]. Выявлено, что стимуляция нресипаптиче-ских дофамииовых рецепторов сопровождается иигибировани-ем высвобождения дофамипа из дофамипергических нервов.
Дофаминовые рецепторы, расположенные на холинергичес-ких нейронах, опосредуют модулирующее влияние дофамина па высвобождение ацетилхолииа [Cubeddu Z.X., Hoffman I.S., 1983].
Обнаружено, что двигательную стимуляцию вызывают до-фаминовые агописты: эргометрип [Pijnenburg A.J. et al.,1973], АДТН [Elkhawad A.O., Woodruff G.N., 1975; Woodruff G.N., Andrews C.D., 1979], а также амфетамин, стимулирующий высвобождение эндогенного дофамина [Taylor К.A., Snyder S.H., 1971]. Позднее было установлено, что данный эффект агонистов дофамипа обусловлен их влиянием на центральные дофа-мииергические системы. Показано, что двустороннее введение в ядро accumbens крыс эргометрипа и АДТН приводит к продолжительному увеличению у них двигательной активности [Pijnenburg A.J., 1973; Elkhawad A.O., Woodruff G.N., 1975; Woodruff G.N., Andrews C.D., 1979]. Данный стимулирующий
эффект АДТН избирательно блокируется при впутрибрюшин-ном введении крысам низких доз флупеитиксола, флуфепази-па, или галоиеридо:a [Elkhawad А.О., Woodruff G.N., 1975; Woodruff G.H., Andrews C.D., 1978]. Сулышрид подавлял этот эффект АДТН в относительно высокой дозе (20 мг/кг) [Woodruff G.H., Andrews C.D., 1979], что может быть связано с его слабым проникновением в головной мозг. При непосредственном введении сулышрида в ядро accumbens on блокировал эффект АДТН в дозе 1 мкг.
Активность S-( — )-сулышрида в этом отношении была в 25 раз выше, чем К-(+)-сулышрида [Andrews C.D., Woodruff G.H., 1978].
Одним из основных способов прямого изучения локализации и характеристик дофаминовых рецепторов в настоящее время является метод исследования связывания меченных тритием лигапдов с этими рецепторами. В качестве таких ра-диолигандов используют антагонисты: 3Н-галоперидол [Creeese I. et al., 1975; Seeman P., 1975], 3Н-снироперидол [Leysen J.E. et al., 1978], 3Н-цис (г)-флунептиксол [Hyttel J., 1980], 3Н-домперидон [Baudry M. et al., 1979], 3Н-сулыш-pHu[TheodoronA.E., 1979;FreedmanS.B., Woodruff G.N., 1981;

метода. Дофамипергические нейроны компактной зоны черной субстанции идентифицируют но изменению их электрической активности в ответ на внутривенное введение ацоморфина и других агонистов и антагонистов дофаминовых рецепторов [Guyenet P.C., Aghajanian O.K., 1978; Bunney B.S., 1979], если они проходят через гематоэпцефалический барьер. Дофамипо-вые аутореценторы модулируют высвобождение и синтез до-фамипа [Carlssgon А., 1975; Bunney В.S., 1979; Haubrich D.R., Pflueger A.B., 1982]. Выявлено, что стимуляция нресипаптиче-ских дофамииовых рецепторов сопровождается иигибировани-ем высвобождения дофамипа из дофамипергических нервов.
Дофаминовые рецепторы, расположенные на холинергичес-ких нейронах, опосредуют модулирующее влияние дофамина па высвобождение ацетилхолииа [Cubeddu Z.X., Hoffman I.S., 1983].
Обнаружено, что двигательную стимуляцию вызывают до-фаминовые агописты: эргометрип [Pijnenburg A.J. et al.,1973], АДТН [Elkhawad A.O., Woodruff G.N., 1975; Woodruff G.N., Andrews C.D., 1979], а также амфетамин, стимулирующий высвобождение эндогенного дофамина [Taylor К.A., Snyder S.H., 1971]. Позднее было установлено, что данный эффект агонистов дофамипа обусловлен их влиянием на центральные дофа-мииергические системы. Показано, что двустороннее введение в ядро accumbens крыс эргометрипа и АДТН приводит к продолжительному увеличению у них двигательной активности [Pijnenburg A.J., 1973; Elkhawad A.O., Woodruff G.N., 1975; Woodruff G.N., Andrews C.D., 1979]. Данный стимулирующий
эффект АДТН избирательно блокируется при впутрибрюшин-ном введении крысам низких доз флупеитиксола, флуфепази-па, или галоиеридо:a [Elkhawad А.О., Woodruff G.N., 1975; Woodruff G.H., Andrews C.D., 1978]. Сулышрид подавлял этот эффект АДТН в относительно высокой дозе (20 мг/кг) [Woodruff G.H., Andrews C.D., 1979], что может быть связано с его слабым проникновением в головной мозг. При непосредственном введении сулышрида в ядро accumbens on блокировал эффект АДТН в дозе 1 мкг.
Активность S-( — )-сулышрида в этом отношении была в 25 раз выше, чем К-(+)-сулышрида [Andrews C.D., Woodruff G.H., 1978].
Одним из основных способов прямого изучения локализации и характеристик дофаминовых рецепторов в настоящее время является метод исследования связывания меченных тритием лигапдов с этими рецепторами. В качестве таких ра-диолигандов используют антагонисты: 3Н-галоперидол [Creeese I. et al., 1975; Seeman P., 1975], 3Н-снироперидол [Leysen J.E. et al., 1978], 3Н-цис (г)-флунептиксол [Hyttel J., 1980], 3Н-домперидон [Baudry M. et al., 1979], 3Н-сулыш-pHu[TheodoronA.E., 1979;FreedmanS.B., Woodruff G.N., 1981;

Woodruff G.N., Freedman S.B., 1981] и агоаисты: 3Н-аномор-фин [Seeman P. et al., 1976] и 3Н-АДТН [Roberts PJ. et al., 1977; Davis A. et al., 1979; Woodruff G.N. et al., 1979]. Поскольку эти лиганды в ряде случаев связываются не только с дофамииовыми, но и с другими рецепторами [Leysen J.E., 1978], для оценки их специфического связывания с дофаминовыми рецепторами ткань предварительно инкубируют с блокатора-ми серотопиповых и порадрепалшювых рецепторов.
Связывание •)Н-сулышрида с высоко и частично очищенными мембранами синантосом полосатого тела головного мозга крыс линии Вистар характеризовалось константой диссоциации, равной 7,4 и 8,8 пМ соответственно и максимальным числом связывающих участков, равным 240 и 400 пмоль/ мг белка соответственно [Woodruff G.N., Freedman S.B., 1981].
лН-Сулышрид с высокой степенью специфичности связывался также с мембранами ядра accumbens, но не с препаратами мембран клеток коры, мозжечка, гиппокампа [Freedman S.B. etal., 1981]. Поскольку полосатое тело и ядро accumbens богато насыщены дофамииергическими нервами, можно считать, что участки, специфически связывающие 3Н-сулыш-рид, представляют собой ностсииаптические дофаминовые рецепторы. Данное связывание 3Н-сульпиридом ингибировалось иейролептиками [Freedman S.B., 1981; Freedman S.B., Woodruff G.N., 1981].
Кроме ЦНС, присутствие дофаминовых рецепторов обнаружено в сосудах почек и па периферических норадреиерги-ческих нервных окончаниях [Goldberg L.I., 1968]. Дофаминовые рецепторы сосудов почек опосредуют вазодилатацию. Агопистическую активность в отношении этих рецепторов проявляют только соединения с гидроксильными группами в положениях 3 и 4; из 44 изученных [Goldberg L.I. et al., 1968] аминов только эиинин обладал дофамииоподобпой активностью. Агоиисты дофамииовых рецепторов 2-амино-6,7-1,2,3,4-тетрагидропафтален (АДТН) и SKF 38 393 также увеличивают кровоток в почках [Horn M. et al., 1984]. Сосудорасширяющее действие дофамипа подавлялось галоиеридолом, хотя специфичность наблюдалась только в узком диапазоне концентрации [Yeh В.К. et al., 1969].
Эргометрин подавлял сосудорасширяющий эффект дофамипа. Этот эффект дофамипа блокируется сулышридом у собак и морских свинок [Horn M. et al., 1981]. В то же время сульнирид не влияет на расширение сосудов почек, вызываемое (J-адреномиметиком изопреналшюм [Horn M. etal., 1981].
Эксперименты P.H.Kelly (1982) in vitro, в которых была показана способность дофамина индуцировать релаксацию сосудов кролика, подтвердили присутствие дофамииовых рецепторов в почках и позволили предположить, что сходные рецепторы локализованы в портальной вене и аорте. В то же время этим автором было установлено, что релаксирующее действие дофамина на мышцы тощей кишки опосредовано р-адрепоре-цепторами. Проведенный фармакологический анализ влияния адреиергических и дофаминергических веществ на сокращение мышечной оболочки сосудов и мышц тонкой кишки позволили P.H.Kelly (1982) предложить схему взаимоотношений между дофаминовыми и сс-адренергическими рецепторами в этих тканях (схема 5).
Согласно этой схеме, если в тканях есть дофамиповые рецепторы, то галоперидол связывается с ними и в меньшей степени блокирует ос-адрепорецепторы, стимулируемые адреналином и фенилэфрином.
вызываемое (J-адреномиметиком изопреналшюм [Horn M. etal., 1981].
Эксперименты P.H.Kelly (1982) in vitro, в которых была показана способность дофамина индуцировать релаксацию сосудов кролика, подтвердили присутствие дофамииовых рецепторов в почках и позволили предположить, что сходные рецепторы локализованы в портальной вене и аорте. В то же время этим автором было установлено, что релаксирующее действие дофамина на мышцы тощей кишки опосредовано р-адрепоре-цепторами. Проведенный фармакологический анализ влияния адреиергических и дофаминергических веществ на сокращение мышечной оболочки сосудов и мышц тонкой кишки позволили P.H.Kelly (1982) предложить схему взаимоотношений между дофаминовыми и сс-адренергическими рецепторами в этих тканях (схема 5).
Согласно этой схеме, если в тканях есть дофамиповые рецепторы, то галоперидол связывается с ними и в меньшей степени блокирует ос-адрепорецепторы, стимулируемые адре-

налином и фенилэфрином. Вместе с тем поскольку дофамин связывается как с дофаминовыми, так и с адренергическими рецепторами, его агонистические свойства будут проявляться сильнее при действии адреналина, феиилэфрипа или фентола-мииа па адренорецепторы. Об интерференции между дофамин- и адренергическими процессами свидетельствуют также исследования W.Maixner и соавт. (1983), а также B.Bongard и соавт. (1983).
По данным M.Relja (1982), специфическое связывание 3Н-галонеридола с мембранами клеток vas deferens крыс насыщаемо и характеризуется Кд, равной 21 нМ, и В^^, составляющей 74 фмоль/мг белка. (+)-Бутакламол по сравнению со своим фармакологически не активным энантиомером обладал в несколько раз меньшей способностью вытеснять этот ли-гаид, что свидетельствует о стереоспецифичности его связывания. Дофамин (ЮмкМ) уменьшал связывание галоперидола с этими мембранами на 50%. Норадреналин, адреналин и серо-топиа в концентрации 10 мкМ в этом отношении были практически не активными. Эти результаты указывают, что vas deferens имеются дофаминергические рецепторы, и дают возможность предполагать, что влияние дофамина и дофаминергических веществ на сексуальное поведение может быть опосредовано их периферическими эффектами, а не только действием на ЦНС.
Поскольку, согласно данным U.Caruso и соавт. (1982), бло-катор периферических дофамииовых рецепторов домпери-доп у свиней вызывает увеличение концентрации панкреатического нолинентида в крови и повышает количество бикарбонатов в нерфузате двенадцатиперстной кишки, можно считать, что дофаминовые рецепторы играют важную роль в регуляции экзокршшой секреции поджелудочной железы.
Кроме того, есть данные, что дофамин вызывает натрийурез, приводящий к увеличению диуреза у людей, собак, кошек и крыс, независимо от изменений почечного кровотока, скорости клубочковой фильтрации и почечной симпатической активности [Cavero I. et al., 1982]. По данным H.J.Akraffiong и соавт. (1983), В.М.Брюханова (1983), инфузия дофамина в почечную артерию собак увеличивает реабсорбцию глюкозы, а галонеридол блокирует это увеличение.
Так как дофаминергические нейроны присутствуют в почках [Dinerstein RJ. et al., 1978], можно предполагать, что индукция дофамином данных эффектов опосредована дофаминовыми рецепторами канальцев почек.
Вместе с тем поскольку дофамин связывается как с дофаминовыми, так и с адренергическими рецепторами, его агонистические свойства будут проявляться сильнее при действии адреналина, феиилэфрипа или фентола-мииа па адренорецепторы. Об интерференции между дофамин- и адренергическими процессами свидетельствуют также исследования W.Maixner и соавт. (1983), а также B.Bongard и соавт. (1983).
По данным M.Relja (1982), специфическое связывание 3Н-галонеридола с мембранами клеток vas deferens крыс насыщаемо и характеризуется Кд, равной 21 нМ, и В^^, составляющей 74 фмоль/мг белка. (+)-Бутакламол по сравнению со своим фармакологически не активным энантиомером обладал в несколько раз меньшей способностью вытеснять этот ли-гаид, что свидетельствует о стереоспецифичности его связывания. Дофамин (ЮмкМ) уменьшал связывание галоперидола с этими мембранами на 50%. Норадреналин, адреналин и серо-топиа в концентрации 10 мкМ в этом отношении были практически не активными. Эти результаты указывают, что vas deferens имеются дофаминергические рецепторы, и дают возможность предполагать, что влияние дофамина и дофаминергических веществ на сексуальное поведение может быть опосредовано их периферическими эффектами, а не только действием на ЦНС.
Поскольку, согласно данным U.Caruso и соавт. (1982), бло-катор периферических дофамииовых рецепторов домпери-доп у свиней вызывает увеличение концентрации панкреатического нолинентида в крови и повышает количество бикарбонатов в нерфузате двенадцатиперстной кишки, можно считать, что дофаминовые рецепторы играют важную роль в регуляции экзокршшой секреции поджелудочной железы.
Кроме того, есть данные, что дофамин вызывает натрийурез, приводящий к увеличению диуреза у людей, собак, кошек и крыс, независимо от изменений почечного кровотока, скорости клубочковой фильтрации и почечной симпатической активности [Cavero I. et al., 1982]. По данным H.J.Akraffiong и соавт. (1983), В.М.Брюханова (1983), инфузия дофамина в почечную артерию собак увеличивает реабсорбцию глюкозы, а галонеридол блокирует это увеличение.
Так как дофаминергические нейроны присутствуют в почках [Dinerstein RJ. et al., 1978], можно предполагать, что индукция дофамином данных эффектов опосредована дофаминовыми рецепторами канальцев почек.
При введении крысам больших доз дофамииа его диуретический эффект исчезает, что может быть связано с активацией ос-адренорецепторов почек [Берхин Е.Б., 1985]; доказательством этого служит тот факт, что при блокаде фентоламином ос-адре-норецепторов и в больших дозах дофамин усиливает диурез.
Таким образом, представленные сведения о дофаминовых рецепторах свидетельствуют об их широком распространении в организме млекопитающих. Не исключено, что последующие эксперименты позволят установить локализацию дофаминовых рецепторов еще в каких-либо органах и тканях. Однако накопившийся материал требует осмысления и классификации.
