
- •Часть I патологические
- •Глава 1 болезнь и типовой патологический процесс
- •Глава 2 наследственный фактор в возникновении и развитии заболеваний
- •Глава 3 гипоксия
- •Глава 4
- •Глава 5
- •Глава 6
- •Глава 7
- •Глава 8
- •Глава 9
- •Классификации степени тяокести циркуляторной гипоксии миокарда (функциональных классов стенокардии)
- •Глава 10 голодание
- •Влияние гормонов на обмен веществ при голодании и в остром периоде после тяжелых ранений и травм
- •Глава 11 типовые нарушения липидного обмена
- •Глава 12 воспаление
- •Глава 13
- •Глава 14 канцерогенез
- •Часть II патофизиология
- •Глава 15
- •Глава 16
- •Глава 17
- •Глава 18
- •Глава 19
- •Глава 20
- •Глава 21
- •Глава 22 почечная недостаточность
- •Глава 23
- •Альбумин
- •Факторы свертывания крови
- •Транспортные белки
- •Глава 24
- •Глава 25 патогенез дисфункций системы пищеварения на уровне кишечника
- •Глава 26
- •Глава 27 сахарный диабет
- •Глава 28 патофизиология наиболее частых эндокринопатий
- •Глава 29 реакции повышенной чувствительности
- •Глава 31 аутоиммунный механизм развития болезней
- •Глава 32 анемии
- •Увеличение системного транспорта кислорода
- •Глава 33
- •Всеволод Юрьевич шанин
Глава 31 аутоиммунный механизм развития болезней
В основе аутоиммунного механизма возникновения и развития болезней лежит потеря организмом способности распознавать нормальные ткани, клетки и антигены (аутоантигены) в качестве принадлежащих организму больного. В результате возникает реакция системы иммунитета, повреждающая нормальные аутоантигены, клетки, ткани и вызывающая аутоимунные болезни.
Некоторые иммунные реакции в основном возникают через образование иммунных комплексов (комплексов антиген-антитело). Основное звено патогенеза других - это атака нормальных клеток организма больного его Т-лимфоцитами. Тем не менее, в любую аутоиммунную реакцию в той или иной степени обычно оказываются вовлеченными все клеточные и молекулярные эффекторы системы иммунитета. При большинстве аутоиммунных болезней система иммунитета начинает вырабатывать антитела к аутоантигенам (аутоантитела).
Клеточными элементами системы иммунитета, взаимодействия между которыми обеспечивают иммунологическую толерантность, то есть состояние ареактивности системы иммунитета по отношению к аутоантигенам, являются клетки системы мононуклеарных фагоцитов, Т- и В-лимфоциты, а также антиген-презентирующие В-клетки костного мозга. При этом определяющую роль в поддержании иммунологической толерантности играет состояние ареактивности (иммунологической толерантности) Т- и В лимфоцитов (рис. 31.1)
Многие из аутоантигенов (тиреоглобулин, гормоны белковой природы, растворенные в жидкой части плазмы крови аутоантигены наружных клеточных мембран и др.) в физиологических условиях циркулируют с кровью в небольшой концентрации. При этом толерантность к ним поддерживается только через ареактивность Т-клеток, а не посредством толерантности В-лимфоцитов. Известно, что Т-клетки способны приобретать толерантность под влиянием интенсивной стимуляции массивными дозами антигенов. В-лимфоциты этим свойством обладают в значительно меньшей мере. Даже толерантные В-клетки в ответ на стимуляцию аутоантигенами могут начать вырабатывать аутоантитела с низкой аффинностью (сродством) к данным нормальным антигенам организма больного. Все это определяет возможность непосредственной стимуляции аутоантигенами в патологических условиях В-клеток в силу их меньшей, чем у тимоцитов, способности приобретать толерантность. Такую стимуляцию называют антигенной стимуляцией в обход толерантных Т-лимфоцитов-хелперов. Необходимое условие иммунологической толерантности по отношению к аутоантигену - это его взаимодействие с иммунокомпетентными клетками.
Ареактивная
(толерантная)
Т-клетка
Стимуляция
Т-клетки аутоантигенами
Аутоантигены
Отсутствие
влияний Т- Нет выработки
хелпера
на В-клетку аутоантител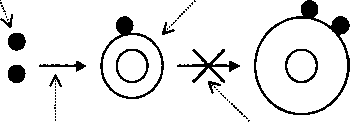
![]()
Рис. 31.1. Принципиальная схема поддержания иммунологической толерантности
Поэтому к аутоантигенам, существующим в клетках и органах изолированно от системы иммунитета, не может быть иммунологической ареактивно- сти. Отграниченность внутриклеточных и внутриорганных аутоантигенов от взаимодействия с иммунокомпетентными клетками часто не бывает полной. Например, такой внутриорганный аутоантиген как тиреоглобулин циркулирует с кровью в минимальной концентрации, и к нему у здоровых людей выявляют иммунологическую толерантность. Тем не менее, она исчезает при соответствующем аутоиммунном поражении щитовидной железы. Сами по себе аутоиммунные болезни приводят к высвобождению пораженными клетками изолированных от системы иммунитета аутоантигенов в циркулирующую кровь, причем часто высвобождаются именно те аутоантигены, к которым и вырабатываются аутоантитела. Это не подвергает аутоиммунную болезнь обратному развитию. Например, при системной красной волчанке в кровь из погибших клеток высвобождаются именно те аутоантигены (фрагменты дезоксирибонуклеиновой кислоты), к которым вырабатываются аутоантитела. В результате постоянного взаимодействия данных ядерных аутоантигенов с системой иммунитета во внутренней среде иммунологическая толерантность к ним не восстанавливается, а системная красная волчанка не исчезает.
Одним из патогенетических механизмов, действие которых приводит к аутоиммунным заболеваниям, можно считать патогенную стимуляцию системы иммунитета вследствие появления по ходу онтогенеза в структуре аутоантигена новых детерминант, к которым нет иммунологической толерантности. Это вызывает образование аутоантител, так как ареактивные Т- лимфоциты в результате взаимодействия с измененным аутоантигеном как носителем новых детерминант начинают оказывать на В-клетки хелперные влияния. Следует заметить, что при подавляющем большинстве известных сегодня аутоиммунных болезней с помощью современных методов исследования не удается выявить каких-либо изменений структуры аутоантиге
на, к которому в результате дизрегуляции иммунологической толерантности система иммунитета вырабатывает антитела.
Не исключено, что побочные эффекты некоторых лекарственных средств, приводящие к аутоиммунным болезням, связаны с тем, что препарат, его молекулярная составляющая или продукт их биологической трансформации фиксируются на поверхности (в структуре) аутоантигенов в качестве гаптенов или меняют их структуру с появлением новых эпитопов, к которым нет иммунологической ареактивности Т-клеток. Обычно при таком побочном эффекте лекарственных средств не происходит формирование нового эпитопа на аутоантигене, с которым взаимодействует Т-лимфо- цит. Можно, кроме того, предположить, что лекарственное средство или продукты его биологической трансформации изменяют какую-либо независимую молекулу, участвующую в иммунологическом узнавании.
Полагают, что аутоиммунная гемолитическая анемия как ятрогенная болезнь вследствие побочного эффекта альфа-метилдофа возникает в результате изменения структуры клеточной поверхности эритроцита под влиянием препарата. В результате участки клеточной поверхности эритроцитов начинают нести детерминанты, которые вступают в прямое взаимодействие с В-клетками, способными к распознаванию антигена Ю1.
Системное действие изониазида приводит к образованию антител к элементам клеточного ядра (антинуклеарные аутоантитела), что обуславливает аутоиммунный артрит, который сохраняется и после отмены препарата. В данном случае первичное звено патогенеза аутоимунной болезни закрепляется в виде изменения строения аутоантигена или независимой молекулы, участвующей в иммунологическом распознавании.
Из других ятрогенных аутоиммунных болезней, связанных с действием лекарственных препаратов, следует выделить системную красную волчанку у больных как осложнение лечения новокаинамидом, а также миастению в результате побочного эффекта пенициллинов.
Специфичность антител и иммунокомпетентных клеток определенного идиотипа по отношению к соответствующей детерминанте (эпитопу) не абсолютна. Поэтому стимуляция системы иммунитета чужеродными антигенами всегда в определенной степени связана с риском аутоиммунной реакции. При возникновении аутоиммунной реакции такого генеза детерминанта, принадлежащая какому-либо чужеродному перекрестно реагирующему антигену, после попадания во внутреннюю среду организма больного через стимуляцию его системы иммунитета вызывает образование аутоантител. Напомним, что перекрестно реагирующий антиген при взаимодействии с системой иммунитета индуцирует образование антител, способных образовывать иммунные комплексы с детерминантами других антигенов (одна антигенная детерминанта перекрестно реагирует с детерминантой другого антигена). Таков в основном патогенез аутоиммунного энцефалита как осложнения парентерального введения антирабической вакцины, содержащей разнообразные антигены ткани головного мозга. Некоторые из антигенов болезнетворных микроорганизмов содержат детерминанты, перекрестно реагирующие с детерминантами нормальных аутоантигенов. В результате взаимодействие таких чужеродных антигенов бактериального и другого происхождения с системой иммунитета больного приводит к образованию аутоантител и аутоиммунной болезни. Так, при ревматизме антитела к стрептококку являются аутоантителами, взаимодействующими с нормальными аутоантигенами сердечной мышцы- У 50 % детей, страдающих от ревматической хореи, то есть от связанного с ревматизмом поражения нервной ткани (хорея Сиденхема), с кровью циркулируют аутоантитела, реагирующие как с нейронами, так и с мембранами стрептококка. Известно, что аутоантитела, взаимодействующие с нормальными аутоантигенами слизистой оболочки толстой кишки у больных неспецифическим язвенным колитом, перекрестно реагируют с антигенами Escherichia coli.
Под сопряженным распознаванием в данном контексте следует понимать реакцию системы иммунитета, при которой патогенно измененный компонент клеточной мембраны вызывает реакцию системы иммунитета с аналогичными нормальными участками клеточной мембраны, в том числе и других клеток. Компонентом, способствующим реакции системы иммунитета на нормальную антигенную детерминанту, является модифицированный под влиянием лекарственных средств или вирусов участок клеточной мембраны. В частности, препараты и продукты их биологической трансформации меняют структуру участков клеточной мембраны как гап- тены, а вирусные антигены оказываются встроенными в плазматические мембраны. Не исключено, что таков патогенез аутоиммунной гемолитической анемии через образование холодовых агглютининов к групповому антигену крови I после инфицирования организма больного Mycoplasma pneumonia.
При большинстве аутоиммунных заболеваний аутоантитела относятся к одному или в основном к одному идиотипу. Идиотип - это антигенная детерминанта, придающая уникальность молекуле иммуноглобулина. Антитела одного идиотипа образуются В-лимфоцитами определенного клона. Идиотипы есть и у Т-лимфоцитов. Идиотип Т-клеток- это антигенная детерминанта изменчивой по структуре части рецептора Т-лим- фоцита, которая определяет специфичность иммунокомпетентной клетки по отношению к определенному антигену. При системной иммунной реакции в ответ на антигенную стимуляцию образуются антитела к идиоти- пам собственных иммуноглобулинов (идиотип-антиидиотипические взаимодействия). Идиотип-антиидиотипические взаимодействия можно считать механизмом регуляции реакции системы иммунитета в ответ на антигенную стимуляцию. Часто встречающиеся идиотипы, присущие антителам разной специфичности (перекрестно реагирующие идиотипы), служат эпитопами для паратопов антиидиотипических антител. Идиотип- антиидиотипические взаимодействия происходят не только на уровне иммуноглобулинов, но и присущи Т-лимфоцитам хелперам и супрессорам. Лимфоциты могут специфически реагировать с идиотипами рецепторов других лимфоцитов, что определяют как сетевые взаимодействия. Сетевое взаимодействие представляет собой один из механизмов регуляции системной иммунной реакции.
Идиотипы определенных антител могут перекрестно реагировать с идиотипами Т- и В-клеток. В результате образуются антитела специфичные не только по отношению к идиотипам данных антител, но и к идиоти- пам определенных иммуноцитов. При этом посредством перекрестного реагирования происходит активация иммуноцитов и система иммунитета может начать уничтожать и элиминировать антигены, которые не участвовали в индукции иммунного ответа.
Выделяют следующие основные механизмы возникновения аутоимун- ных поражений, действие которых связано с идиотип-антиидиотипически- ми взаимодействиями.
Перекрестная реакция микробного антигена с идиотипом аутореактивного Т-лимфоцита.
Образование антимикробных антител с идиотипом идентичным иди- отипу аутореактивных Т-лимфоцитов. Образование таких антимикробных антител вызывает продукцию соответствующих антиидио- типических иммуноглобулинов, что активирует аутореактивные Т-клетки, несущие идиотип общий с идиотипом антимикробных антител.
Образование антимикробных антител, которые являются антиидио- типическими антителами к идиотипам аутореактивных иммуноглобулинов.
Образование антител к вирусу приводит к образованию антидиоти- пических антител к рецепторам клеточной поверхности, с которыми избирательно связывается данный вирус. Такие рецепторы могут быть эффекторами систем регуляции разных уровней структурнофункциональной организации организма. Их соединение с антииди- отипическими аутоантителами обуславливает дизрегуляцию. В этой связи уместно напомнить, что бета-адренорецепторы представляют собой рецепторы к определенным вирусам, а вирус бешенства - это лиганда к ацетилхолиновым рецепторам.
Т-хелперы специфичные к идиотипу иммуноглобулинового рецептора Т-лимфоцитов, вступая в сетевые идиотип-антиидиотипические, могут активировать иммуноциты, несущие рецептор с данным идиотипом. Это служит одним из механизмов системной иммунной реакции в ответ на антигенную стимуляцию. Если какой-либо экзогенный чужеродный антиген вызывает образование антител, несущих идиотип, перекрестно реагирующий с рецепторами аутореактивных Т- и В-рецепторов, то образование ан- тиидиоитпических антител активирует данные иммуноциты. Активированные иммуноциты вызывают аутоиммунную реакцию.
Стимуляция системы иммунитета чужеродными антигенами через идиотип-антиидиотипические взаимодействия может приводить к образованию аутоантител к гормонам. При этом специфичные по отношению к данным антиидиотипическим антителам иммуноглобулины могут быть комплементарными по отношению к рецепторам гормона. Это может нарушить взаимодействие гормона со своим рецептором. Не исключено, что появление в сыворотке крови больного сахарным диабетом антител к инсулину и его рецепторам, представляет собой следствие патогенных идиотип-антиидио- типических взаимодействий. Обходная активация аутореактивных Т-индук- торов, то есть активация данных Т-лимфоцитов не в результате стимуляции системы иммунитета специфическими для Т-индукторов антигенами, в большинстве случаев не может быть устойчивой, так как иммунная система обладает способностью тормозить продукцию аутоантител через соответствующую реакцию Т-супрессоров. В этой связи можно считать, что любые воздействия, снижающие активность и число Т-супрессоров, одновременно повышают продукцию аутоантител. Предположительно в угнетении Т-супрессоров и во вторичной по отношению к нему аутоиммунной реакции может играть роль патогенно высокая активность Т-контрсупрес- соров. Кроме того, есть основанные на экспериментальных данных предположения, что причиной недостаточного числа Т-супрессоров и аутоиммунной реакции может быть врожденно низкая экспрессия на клеточной поверхности молекул 1-Е как стимула образования Т-супрессоров. Можно считать, что одним из гипотетических звеньев патогенеза аутоиммунных болезней является недостаточная экспрессия генов молекул второго класса из главного комплекса тканевой совместимости, обуславливающая недостаточное образование Т-супрессоров.
Не исключено, что такое свойство В-лимфоцитов с поверхностным маркером Ьу 1 как относительная ареактивность по отношению к влияниям Т- супрессоров может быть причиной некоторых аутоиммунных реакций.
Недостаточные регуляторные влияния со стороны Т-клеток на другие клеточные эффекторы системной иммунной реакции могут быть звеном патогенеза системной красной волчанки. Ряд иммунопатологических сдвигов у таких пациентов говорит в пользу такого взгляда на патогенез данного аутоиммунного заболевания:
В-лимфоциты больных системной красной волчанкой продуцируют гораздо больше иммуноглобулинов, чем В-клетки здоровых людей;
у пациентов почти нет неспецифических Т-супрессоров, пролиферацию которых стимулирует конканавалин А;
у больных системной красной волчанкой снижено содержание несущих Бс гамма-рецепторы Т-лимфоцитов, которые подавляют клеточную пролиферацию лимфоцитов в ответ на действие митогена фитолакки.
Существует прямая связь между степенью тяжести системных и локальных аномалий у больных системной красной волчанкой и выраженностью данных иммунопатологических сдвигов.
При поддержании нормальной иммунологической толерантности по отношению к аутоантигенам они экспрессируются геномом клеток на наружной клеточной мембране в сочетании с молекулами первого класса из главного комплекса тканевой совместимости. Это обуславливает невозможность взаимодействия аутоантигенов с аутореактивными Т-лимфоцитами индукторами. Полагают, что при угнетении экспрессии соответствующими генами молекул первого класса из главного комплекса тканевой совместимости присутствие на клеточной поверхности аутоантигенов в комплексе с молекулами второго класса комплекса может вызвать системную
Есть
распознавание
аутоантигена
Молекула
второго класса из главного комплекса
тканевой совместимости
Клетка-
мишень
Молекула
первого класса из главного комплекса
тканевой совместимости
Аутореактивный
Т-лимфоцит
Нет
распознавания аутоантигена аутореактивным
Аутоантиген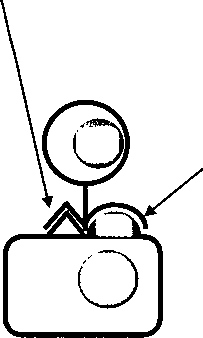
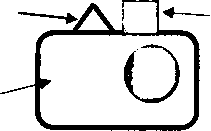
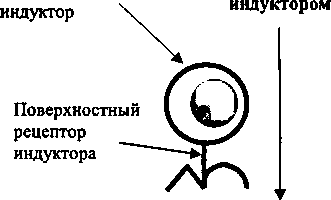
аутоиммунную реакцию (рис. 31.2). Известно, что в клетках щитовидной железы больных аутоиммунным тиреоидитом идет интенсивная экспрессия молекул второго класса из главного комплекса тканевой совместимости. При сахарном диабете на поверхности бета-клеток поджелудочной железы также выявляют повышенную экспрессию молекул второго класса из главного комплекса тканевой совместимости. Не исключено, что повышенная экспрессия молекул второго класса при соответствующих аутоиммунных заболеваниях представляет собой результат активации соответствующих Т-индукторов, которые через действие гамма-интерферона вызывают экспрессию молекул второго класса на клеточной поверхности, тем самым делая клетку более подверженной разрушению в результате аутоиммунной реакции.
Рост частоты аутоиммунных заболеваний по ходу старения очевидно связан с инволюцией вилочковой железы и лимфоидной ткани как причины недостаточного поддержания иммунологической толерантности по отношению к аутоантигенам. По-видимому, большая частота аутоиммунных заболеваний у женщин связана с влияниями эстрогенов.
