
- •Часть I патологические
- •Глава 1 болезнь и типовой патологический процесс
- •Глава 2 наследственный фактор в возникновении и развитии заболеваний
- •Глава 3 гипоксия
- •Глава 4
- •Глава 5
- •Глава 6
- •Глава 7
- •Глава 8
- •Глава 9
- •Классификации степени тяокести циркуляторной гипоксии миокарда (функциональных классов стенокардии)
- •Глава 10 голодание
- •Влияние гормонов на обмен веществ при голодании и в остром периоде после тяжелых ранений и травм
- •Глава 11 типовые нарушения липидного обмена
- •Глава 12 воспаление
- •Глава 13
- •Глава 14 канцерогенез
- •Часть II патофизиология
- •Глава 15
- •Глава 16
- •Глава 17
- •Глава 18
- •Глава 19
- •Глава 20
- •Глава 21
- •Глава 22 почечная недостаточность
- •Глава 23
- •Альбумин
- •Факторы свертывания крови
- •Транспортные белки
- •Глава 24
- •Глава 25 патогенез дисфункций системы пищеварения на уровне кишечника
- •Глава 26
- •Глава 27 сахарный диабет
- •Глава 28 патофизиология наиболее частых эндокринопатий
- •Глава 29 реакции повышенной чувствительности
- •Глава 31 аутоиммунный механизм развития болезней
- •Глава 32 анемии
- •Увеличение системного транспорта кислорода
- •Глава 33
- •Всеволод Юрьевич шанин
Глава 17
ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ И АРТЕРИАЛЬНАЯ ГИПОКСЕМИЯ
Основная функция системы внешнего дыхания - это поглощение из внешней среды кислорода и выведение в нее из внутренней среды углекислого газа.
Дыхательная недостаточность - это состояние организма вследствие неспособности системы внешнего дыхания обеспечить:
поглощение легкими 02 и уровень его напряжения в артериальной крови (РаО2), достаточные для адекватного потребностям организма насыщения гемоглобина кислородом;
выведение из организма углекислого газа, позволяющее организму удерживать концентрацию протонов во внеклеточной жидкости и плазме крови ([Н*]) в диапазоне нормальных изменений.
Кроме того, под дыхательной недостаточностью следует понимать неспособность системы внешнего дыханш реагировать ростом поглощения кислорода легкими и экскреции ими углекислого газа в ответ на увеличение потребности организма в кислороде (рост потребления организмом О2) и на возросшую потребность в экскреции углекислого газа (усиление высвобождения углекислого газа в ходе обмена веществ во внутреннюю среду организма).
Снижение в артериальной крови напряжения кислорода и рост в ней напряжения углекислого газа (РаС02) может быть следствием роста потребления кислорода организмом (П02) и образования в нем углекислого газа при физической нагрузке, лихорадке, сепсисе, при неспецифических компенсаторных процессах («стресс-реакция»), при тиреотоксикозе, а также при других патологических состояниях и приспособительных реакциях. При этом в определенные периоды болезни и патологического процесса напряжения газов в крови по мере снижения утилизации организмом свободной энергии возвращаются в «нормальные» пределы. Это не означает устранения терапией дыхательной недостаточности. Она остается скрытой, и проявляет себя артериальными гипоксемией и гиперкапнией при последующих по ходу болезни росте потребления кислорода и образования углекислого газа.
Легочный газообмен происходит на уровне терминальных респираторных единиц (ТРЕ) легких. ТРЕ (респирон) - это часть легких, дистальная по отношению к конечной нереспираторной бронхиоле, которая омывается смешанной венозной кровью, поступающей по ветви легочной артерии (легочной артериоле), параллельной данной терминальной нереспираторной бронхиоле. Легочная артериола распадается на капиллярную сеть, обволакивающую альвеолы и образующую легочные венулы, находящиеся на периферии ТРЕ. Такое строение ТРЕ в структурном отношении обеспечивает продвижение смешанной венозной крови строго из артериол через легочные капилляры в венулы и ее оксигенацию на уровне альвеол.
Дня наиболее полных на уровне одного респирона оксигенации смешанной венозной крови и освобождения ее от углекислого газа (легочный газообмен) необходимо наличие и совпадение во времени двух условий:
Достаточное поступление кислорода из внешней среды в состав альвеолярной газовой смеси, то есть определенный уровень минутной альвеолярной вентиляции (МАВ) дыхательной смесью газов с достаточным содержанием в ней кислорода. Кроме того, достаточная МАВ выступает необходимым условием адекватной экскреции углекислого газа в ходе внешнего дыхания из смешанной венозной крови и альвеолярной газовой смеси во внешнюю среду.
Оптимальное снабжение респирона смешанной венозной кровью.
Если на уровне одного респирона МАВ начинает преобладать над
кровотоком, то есть становится избыточной, то патогенных сдвигов в напряжении кислорода и углекислого газа в крови, которую содержат венулы данного респирона, не произойдет. Однако рост МАВ одних респиро- нов, одной совокупности структурно-функциональных единиц легких, приводит к падению вентиляции других, а значит и к нарушению в них легочного газообмена. Причиной нарушений газообмена в легких может быть и преобладание снабжения смешанной венозной кровью одних рес- пиронов за счет других.
Дыхательная недостаточность - это всегда следствие нарушений соответствия МАВ структурно-функциональных единиц легких, их отделов и частей, всех легких объемной скорости кровотока, то есть расстройств вентиляционно-перфузионных отношений.
В физиологических условиях всегда существует нормальная вариабельность вентиляционно-перфузионных отношений респиронов и отделов легких, которая на уровне всех легких не приводит к дыхательной недостаточности. При дыхательной недостаточности физиологическая вариабельность трансформируется в патологическую. В результате на уровне всей системы внешнего дыхания нарушается легочный газообмен. В силу большей диффузионной способности углекислого газа нарушения легочного газообмена чаще сначала приводят к патогенному падению оксигенации смешанной венозной крови, то есть обуславливают артериальную гипоксемию.
АРТЕРИАЛЬНАЯ ГИПОКСЕМИЯ
Под артериальной гипоксемией понимают патологически низкий уровень оксигенации смешанной венозной крови, в результате которого транспорт кислорода от легких на периферию становится таким низким, что возникает респираторная гипоксия.
Артериальная гипоксемия чаще всего выступает следствием:
нарушений физиологической вариабельности вентиляционно-пер- фузионных отношений (ВПО) респиронов и отделов легких;
патологического внутрилегочного шунтирования крови справа налево, то есть роста объема неоксигенированной смешанной венозной крови, который проходит через легкие в артериальную кровь, не участвуя в легочном газообмене;
снижения парциального давления кислорода во вдыхаемой газовой смеси;
падения напряжения кислорода в смешанной венозной крови (Ру02);
нарушений диффузии газов через альвеоло-капиллярную мембрану;
низкого МАВ, то есть гиповентиляции.
Степень тяжести артериальной гипоксемии оценивают в зависимости от уровня напряжения кислорода в артериальной крови (табл. 17.1).
Таблица
17.1
Степени
тяжести артериальной гипоксемии
Степень
тяжести
РаОг
при дыхании атмосферным воздухом,
мм рт. ст.
Обязательные
лечебные мероприятия
Легкая
80-62
Умеренная
61-51
Инсуффляция
кислорода при самостоятельном
дыхании больного и содержании 02
во вдыхаемой газовой смеси (РЮ2)
в пределах 30-40 %
Тяжелая
50-40
Искусственная
вентиляция легких при РЮ2
не менее, чем 50 %
Крайне
<40
Искусственная
вентиляция легких чис
тяжелая
тым
кислородом
ПАТОЛОГИЧЕСКИЕ ВАРИАБЕЛЬНОСТЬ ВЕНТИЛЯЦИОННО- ПЕРФУЗИОННЫХ ОТНОШЕНИЙ И ШУНТИРОВАНИЕ СМЕШАННОЙ ВЕНОЗНОЙ КРОВИ В ЛЕГКИХ КАК ПРИЧИНЫ АРТЕРИАЛЬНОЙ ГИПОКСЕМИИ
Общая площадь легочной мембраны, через которую происходит диффузия свободных молекул кислорода и углекислого газа, у здоровых людей колеблется от 160 до 200 м2. Эту площадь составляет сумма газообменной поверхности (легочной мембраны) около 100 000 респиронов (ТРЕ) и нескольких миллионов альвеол. Массоперенос кислорода и углекислого газа из альвеолярной газовой смеси в смешанную венозную кровь и в обратном направлении может быть достаточным лишь при условии незатрудненного кровоснабжения определенного числа оптимачьно вентилируемых респиронов. Общий объем крови, которую содержат легочные капилляры, составляет 100 мл. Этот объем крови «растягивается» до тончайшей пленки на поверхности легочной мембраны в пределах всех легких, что в структурно-функциональном отношении обеспечивает наиболее оптимальные условия для нормального легочного газообмена. Критериями соответствия легочного газообмена потребностям организма являются парциальные давления и напряжения газов в альвеолярной газовой смеси, артериальной и смешанной венозной крови (табл. 17.2).
Таблица
17.2
Парциальные
давления (напряжения) кислорода и
углекислого газа в альвеолярной газовой
смеси,
смешанной
венозной и артериальной крови в условиях
относительного покоя у здорового
молодого человека на уровне моря
Парциальные
давления и напряжения газов
Альвеолы
Смешанная
венозная кровь
Артериальная
кровь
ро2
100
40
95
РС02
40
46
40
Вентиляционно-перфузионное отношение (ВПО) на уровне всех легких представляет среднее значение ВПО их респиронов, участков легочной ткани и отделов легких. ВПО всех легких здорового человека в условиях относительного покоя равное 0,8 может свидетельствовать о физиологической вариабельности ВПО в пределах всей легочной паренхимы. При физиологической вариабельности ВПО газообменный дыхательный коэффициенту отношение выделения углекислого газа к потреблению кислорода организмом (ПО2) равен метаболическому дыхательному коэффициенту, то есть отношению образования углекислого газа в ходе обмена веществ к П02, и они оба находятся на уровне близком 0,8.
В легких здорового человека нет патологической вариабельности вен- тиляционно-перфузионных отношений респиронов, участков легочной паренхимы и отделов легких, несмотря на постоянное действие ряда факторов физиологической вариабельности ВПО:
большее растяжение нижележащих и периферических отделов легких на высоте вдоха, обуславливающее преимущественное распределение дыхательного объема в эти участки легких;
подверженность легочного кровотока влияниям со стороны силы земного притяжения, которые приводят к преобладанию кровоснабжения нижележащих респиронов;
зависимость объемной скорости легочного кровотока в различных участках легких от величины дыхательного объема.
Тогда, когда в результате патологического процесса (пневмония, гемопневмоторакс, крайняя стадия респираторного дистресс-синдрома взрослых, ушиб легкого, раневой пульмонит и др.) респироны легких в одинаковой степени теряют и альвеолы и легочные микрососуды, патологической вариабельности ВПО респиронов легких может и не развиться. При этом артериальной гипоксемии в условиях относительного покоя не возникает до тех пор, пока легкие не потеряют 70-80 % респиронов.
Если поступление смешанной венозной крови в какой-либо респирон или часть легких снижается или блокируется, то растет часть дыхательного объема, которая достигает альвеол, но не участвует в легочном газообмене. Это снижает поглощение кислорода всеми легкими, что вызывает падение напряжения кислорода в артериальной крови и артериальную ги- поксемию. Когда рост вентиляции части альвеол не сопровождается адекватным возрастанием кровотока по капиллярам, то из альвеолярной газовой смеси все легкие поглощают меньше кислорода. Это также увеличивает фракцию дыхательного объема, не задействованную для легочного газообмена, и снижает поглощение кислорода легкими. Результатом и того и другого варианта патологической вариабельности ВПО респиронов может быть артериальная гипоксемия. Если в легких одновременно возникают два описанных варианта нарушений ВПО, то на уровне всей системы внешнего дыхания это приводит к снижению физиологической площади легочной мембраны. Физиологическая площадь легочной мембраны - это та ее часть, диффузия через которую кислорода и углекислого газа приводит к полным, то есть ограниченным только градиентами парциальных давлений (напряжений), поглощению кислорода из альвеолярной газовой смеси, оксигенации смешанной венозной крови и ее освобождению от углекислого газа. Снижение физиологической площади легочной мембраны до определенного уровня приводит к артериальной гипоксемии.
Стеноз, обтурация легочной артерии или ее ветвей, а также множественная эмболия легочных микрососудов (диссеминированное внутрисо- судистое свертывание, жировая эмболия, тромбоз микросгустками перелитой крови, агрегатами активированных тромбоцитов и нейтрофилов при травматическом шоке и сепсисе) ведут к образованию альвеолярных мертвых пространств, то есть вентилируемых, но не омываемых смешанной венозной кровью альвеол. В результате возникает различие между РаС02 и парциальным давлением углекислого газа в конечной части выдыхаемого воздуха, которое считают эквивалентным парциальному давлению углекислого газа в альвеолярной газовой смеси, РАС02. Это результат полного прекращения в респиронах с только мертвыми альвеолярными пространствами переноса углекислого газа через легочную мембрану. Смешанная венозная кровь из таких респиронов по коллатера- лям устремляется в легочные венулы других ТРЕ, не отдав в альвеолярную газовую смесь углекислый газ. В результате возрастает шунтирование смешанной венозной крови в легких, что обуславливает:
снижение различия между напряжением углекислого газа в смешанной венозной крови и РаС02;
рост различия между РаС02 и РАС02.
Первоначально при синдроме распространенной микроэмболизации в легких компенсаторная гипервентиляция в ответ на рост РаС02 через увеличение экскреции углекислого газа предотвращает гиперкапнию, то есть патологически высокое РаС02. Если в результате обструкции легочных микрососудов поглощение кислорода легкими падает в такой степени, что возникает артериальная гипоксемия, то снижение кислородной емкости крови и падение в ней РаОг оказывают на сердце отрицательное инотропное действие. Падение сократимости сердца может привести к снижению минутного объема кровообращения (МОК).
Падение минутного объема кровообращения в данном случае происходит не только из-за артериальной гипоксемии. МОК снижается вследствие роста общего легочного сосудистого сопротивления как причины правожелудочковой сердечной недостаточности. Компенсаторная гипервентиляция в ответ на артериальную гипоксемию повышает ПОг, что ускоряет развитие циркуляторной гипоксии. Циркуляторная гипоксия при синдроме распространенной микроэмболизации в легких представляет собой результат легочной артериальной гипертензии, правожелудочковой сердечной недостаточности и связанного с ними падения МОК при высокой из-за повышенных энерготрат в системе внешнего дыхания потребности всего организма в кислороде.
Главными симтомами синдрома распространенной микроэмболизации в легких являются одышка и тахикардия, которые возникают и обостряются даже при минимальном увеличении физической нагрузки. Если при обследовании таких больных над легкими не слышат хрипов, рентгенологическое исследование не выявляет патологических изменений в легких, а анамнез не содержит данных, свидетельствующих о предшествующей явной или скрытой хронической сердечной недостаточности, то следует заподозрить распространенную эмболизацию микрососудов легких. Когда, кроме того, есть электрокардиографические признаки гипертрофии правого желудочка, то развитие синдрома сомнений вызывать не должно.
Распространенная микроэмболизация в легких - это не единственная причина возникновения в их паренхиме альвеолярных мертвых пространств. Причиной альвеолярных мертвых пространств служат патологические изменения легких при эмфиземе, которые через облитерацию микрососудов блокируют кровоснабжение респиронов.
Если вентиляция респирона полностью прекращается при сохраненном поступлении в него смешанной венозной крови (ВПО=0), то по вену- лам такого респирона начинает оттекать смешанная венозная кровь. Эта кровь проходит через легкие, не участвуя в легочном газообмене и составляя объем (величину) истинного патологического внутрилегочного шунтирования смешанной венозной крови.
Объем истинного патологического внутрилегочного шунтирования составляет та часть попавшей в легкие смешанной венозной крови, которая примешивается к артериальной, пройдя по капиллярам и венулам полностью невентилируемых респиронов.
Если вентиляция респиронов, участков и отделов легких, снижается без адекватного уменьшения в них объемной скорости кровотока, то легочный газообмен в них не прекращается, но продолжает оксигенироваться лишь часть поступившей в них смешанной венозной крови. Ос
тавшаяся часть составляет величину физиологического шунтирования, которая вместе с объемом истинного патологического внутрилегочного шунтирования составляет у больных величину патологического внутри- легочного шунтирования смешанной венозной крови.
Обструктивные расстройства альвеолярной вентиляции, вызывая ее неравномерность, резко увеличивают число респиронов, в которых из-за низкой относительно снабжения смешанной венозной кровью вентиляции происходит физиологическое шунтирование смешанной венозной крови. Таким образом формируется основное звено патогенеза артериальной ги- поксемии у больных с обструктивными расстройствами внешнего дыхания вследствие бронхиальной астмы и астматического статуса.
ОБСТРУКТИВНЫЕ И РЕСТРИКТИВНЫЕ РАССТРОЙСТВА
АЛЬВЕОЛЯРНОЙ ВЕНТИЛЯЦИИ
Потеря легкими нормальных респиронов снижает физиологическую площадь легочной мембраны и через утрату части сосудов из системы легочной артерии повышает общее легочное сосудистое сопротивление. В результате поглощение кислорода легкими ограничивается патологически низким верхним пределом. Такое нарушение альвеолярной вентиляции и легочного газообмена называют рестрикционным (рестрикцией). О рестрикционном (лат. геэ^юйо, ограничение) нарушении легочного газообмена может свидетельствовать частое и поверхностное дыхание.
Рестриктивные расстройства внешнего дыхания - это результат ограничения способности достижения системой внешнего дыхания своих конечных полезных приспособительных результатов из-за потери главным эффектором системы, легкими, определенного числа нормально функционирующих респиронов.
Сравнительно недавно одной из причин падения поглощения кислорода легкими считали альвеолярно-капиллярный блок, то есть снижение массопереноса кислорода в респиронах, связанное с утолщением легочной мембраны вследствие патологических процессов в интерстиции легких. Сейчас ясно, что в большинстве случаев хронических заболеваний с патологическими изменениями в легочном интерстиции падение поглощения кислорода легкими возникает как рестрикционное нарушение легочного газообмена.
Обструктивные расстройства внешнего дыхания (обструкция) (лат. оЬБ^исйо - преграда, помеха) связаны с аномальным возрастанием сопротивления продвижению смеси газов по дыхательным путям во время вдоха и (или) выдоха.
Выделяют стабильное обструктивное расстройство внешнего дыхания, которое выявляют как в фазу вдоха, так и в фазу выдоха. Стабильную обструкцию обуславливает постоянное сужение верхних дыхательных путей, связанное со злокачественными опухолями, пороками развития и последствиями ранений и травм соответствующей локализации. К стабильной обструкции приводит и постоянное патогенное сужение дыхательных путей небольшого диаметра при хроническом обструктивном бронхите и бронхиальной астме. Лабильное обструктивное расстройство внешнего дыхания преимущественно выражено или в фазу вдоха или во время выдоха, то есть может быть инспираторным или экспираторным. При параличе дыхательных связок или трахеомаляции на экстратора- кальном уровне обструкция в основном или исключительно возникает во время вдоха, являясь инспираторной. Экспираторная обструкция обычно происходит на интраторакальном уровне. Такую обструкцию вызывают: коллапс интраторакальной части трахеи из-за трахеомаляции, спадение бронхов и бронхиол небольшого диаметра вследствие патологических изменений легочного интерстиция при эмфиземе.
При бронхиальной астме и хроническом обструктивном бронхите просвет дыхательных путей небольшого диаметра (от сегментарных бронхов до терминальных нереспираторных бронхиол) постоянно сужен вследствие их закупорки секретом, бронхоспазма и отека слизистой оболочки. Это обуславливает как инспираторные, так и экспираторные об- структивные расстройства альвеолярной вентиляции. При этом в результате патологической динамической компрессии дыхательных путей (см. ниже) экспираторные обструктивные расстройства выражены в большей степени. Рост линейной скорости газотока в дыхательных путях небольшого диаметра из-за их сужения, патологическая динамическая компрессия таких дыхательных путей в фазу выдоха вызывают колебания выдыхаемой газовой смеси и стенок дыхательных путей, которые при аускультации воспринимаются как свистящие (в основном экспираторные) хрипы.
При нормальных регуляции функции внешнего дыхания и состоянии ее эффекторов существует верхний предел объемной скорости газотока выдыхаемой газовой смеси, выше которого скорость не растет, несмотря на увеличение силы сокращений дыхательных мышц. Верхний предел объемной скорости газотока при выдохе обусловлен динамической компрессией дыхательных путей
Для осуществления выдоха внутриальвеолярное давление должно возрасти от атмосферного, которое мы будем считать нулевым. Рост давления смеси газов в просвете альвеол происходит через увеличение давления в плевральной полости, а значит и в перибронхиальных пространствах легких. Статическое давление выдыхаемой газовой смеси снижается по мере ее продвижения по дыхательным путям. В результате во время выдоха снижается градиент давлений между интерстицием легких (пе- рибронхиальные пространства) и просветом дыхательных путей. Как только где-либо на интраторакальном уровне давление в паренхиме легких и в перибронхиальных пространствах начинает преобладать над статическим давлением газовой смеси в просвете дыхательных путей (градиент давлений становится положительным), то происходит сдавление (компрессия) дыхательных путей, если только его не предотвращает ригидность их стенки.
Градиент давлений между начальной (А) и конечной (В) точками определенного сегмента дыхательных путей находится в прямой связи с сопротивлением данного сегмента. Сужение просвета бронхиол и бронхов небольшого диаметра повышает сопротивление дыхательных путей данного уровня, увеличивает соответствующий градиент давлений и через падение статического давления выдыхаемой газовой смеси (Р2, Р'2, рис. 17.1) может привести к спадению дыхательных путей.
А
Р.-Р^У.хИ,
Р] >
Р2
Рис.
17.1.
Снижение давления в просвете дыхательных
путей, обусловленное ростом их
сопротивления в результате сужения
просвета (Р1-Р2
- градиент статических давлений в
просвете дыхательных путей; Я -
сопротивление дыхательных путей; V -
объемная скорость продвижения вдыхаемой
газовой смеси по дыхательным путям) В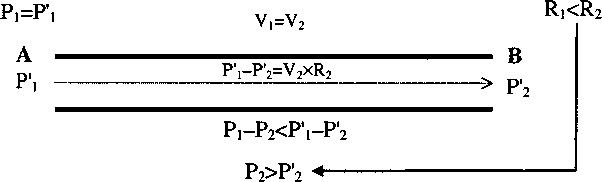
Рост сопротивления дыхательных путей снижает объемную скорость газотока по дыхательным путям, но линейная скорость продвижения выдыхаемой газовой смеси по отдельным бронхиолам и бронхам растет вследствие сужения их просвета. В результате падает статическое давление газовой смеси в просвете дыхательных путей, что служит еще одним из механизмов их патологической динамической компрессии, связанной с патологическим ростом сопротивления дыхательных путей.
Патологическая динамическая компрессия дыхательных путей служит одной из причин легочной эмфиземы у больных с хроническими обструк- тивными заболеваниями легких. Эмфизема развивается через постоянную задержку части выдыхаемой газовой смеси в легких и перераздувание альвеол после полного спадения дыхательных путей в результате патологической динамической компрессии. При этом параллельно с развитием эмфиземы выявляют патологическое возрастание остаточного объема и функциональной остаточной емкости легких.
Патологическая динамическая компрессия дыхательных путей еще в большей степени усиливает их сопротивление, что резко повышает использование свободной энергии для внешнего дыхания и потребление кислорода дыхательными мышцами. Рост потребления кислорода для внеш
него дыхания повышает потребление кислорода всем организмом (П02). Если при этом нет адекватного возрастания поглощения кислорода легкими, то возникает артериальная гипоксемия. При обструктивных расстройствах альвеолярной вентиляции не происходит достаточного для предотвращения артериальной гипоксемии роста поглощения кислорода легкими из-за обусловленной обструкцией патологической вариабельности вентиляционно-перфузионных отношений респиронов, участков и отделов легких.
Представим две идентичные по всем функциональным характеристикам структурно-функциональные единицы легких, в которые дыхательная смесь газов поступает по одному бронху (бронхиоле) (рис. 17.2). Из этого бронха дыхательная смесь идет в структурно-функциональные единицы легких по их бронхам (бронхиолам) с одинаковым сопротивлением. Патогенное сужение просвета дыхательных путей структурно-функцио- нальных единиц легких происходит неравномерно, то есть происходит асинхронное реагирование структурно-функциональных единиц эффектора функций.
Рис.
17.2.
Асинхронное сужение просвета дыхательных
путей как причина неравномерности
вентиляции при вдохе (В1
- сопротивление дыхательных путей
первой структурно-функциональной
единицы легких,
Н2
- второй; г - радиус дыхательных путей;
V - объемная скорость газотока)
Г1=г2
И.
1=1^2 У,=у2
111=1,5112
У,>у2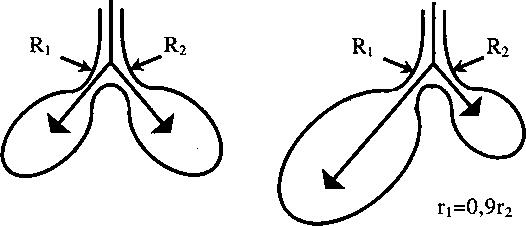
Известно, что при ламинарном характере газотока, который характеризует продвижение смеси газов по дыхательным путям небольшого диаметра, снижение радиуса их просвета в два раза увеличивает их сопротивление в 16 раз. Предположим, что в соответствии с принципом аси- хроннного реагирования после патогенной бронхоконстрикции (сужения просвета) радиус просвета бронхиолы одной структурно-функциональной единицы составляет 90 % радиуса другой. При ламинарном газотоке сопротивление - это обратная функция четвертой степени радиуса. Поэтому такое небольшое различие в радиусах приводит к значительному различию в сопротивлениях, при котором сопротивление бронхиолы одной
структурно-функциональной единицы больше сопротивления другой примерно в полтора раза. При турбулентном газотоке в более крупных по диаметру дыхательных путях небольшие различия в радиусе просвета также обуславливают значительные различия в сопротивлениях.
Разные сопротивления бронхиол приводят к разной объемной скорости тока по ним смеси газов. Время вдоха ограничено. Поэтому часть структурно-функциональных единиц с более низким сопротивлением дыхательных путей заполняется вдыхаемой газовой смесью избыточно, тогда, когда в другие, с высоким сопротивлением, она поступает недостаточно. Это приведет к снижению в конце фазы вдоха в части альвеол легких общего давления газовой смеси и парциального давления кислорода. Снижение РАОг через действие механизма алъвеоло-капиллярного рефлекса (спазм микрососудов прекапиллярного уровня респирона в ответ на падение парциального давления кислорода в альвеолярной газовой смеси) ограничивает снабжение смешанной венозной кровью респиронов, вентиляция которых снижена. Тем не менее, альвеоло-капиллярный рефлекс не может предотвратить снижения физиологической площади легочной мембраны, вызванного неравномерностью альвеолярной вентиляции вследствие ее обструктивных расстройств. Из-за гиповентиляции части респиронов возрастает шунтирование смешанной венозной крови, и возникает артериальная гипоксемия.
Обструктивные расстройства альвеолярной вентиляции при хроническом обструктивном бронхите и бронхиальной астме через увеличение сопротивления дыхательных путей снижают объемную скорость газотока по дыхательным путям в фазу выдоха. Рост сопротивления дыхательных путей приводит к снижению максимальной объемной скорости газотока при выдохе (пиковая скорость), которая у больных бронхиальной астмой находится на уровне меньшем, чем 60 л/мин, что может служить показанием к госпитализации. Падение объемной скорости газотока снижает объем газовой смеси, выдыхаемой при форсированном выдохе за его первую секунду (объем форсированного выдоха за первую секунду, ОФВО. Одновременно, но в меньшей степени, вследствие патологической динамической компрессии дыхательных путей у больного снижается объем максимально возможного и быстрого форсированного выдоха (форсированная жизненная емкость легких, ФЖЕЛ). Это приводит к снижению экспираторного индекса Тиффно, то есть отношения ОФВ1/ФЖЕЛ, до значений меньших, чем 75 %.
Крайняя степень обструктивных расстройств внешнего дыхания - это полная обтурация (закупорка) крупного бронха с прекращением вентиляции респиронов отдела легких. При этом альвеоло-капиллярный рефлекс не прекращает полностью поступление в невентилируемые респироны смешанной венозной крови. В результате кислород из состава альвеолярной газовой смеси уходит в смешанную венозную кровь, альвеолы спадаются, и развивается ателектаз. Истинное патологическое шунтирование смешанной венозной крови в легких при соответствующей распространенности ателектаза может быть причиной артериальной гипоксемии.
НЕДОСТАТОЧНАЯ ВЕНТИЛЯЦИЯ РЕСПИРОНОВ
КАК ПРИЧИНА АРТЕРИАЛЬНОЙ ГИПОКСЕМИИ
Гиповентшяцш - это состояние легочного газообмена, которое характеризуют артериальная гипоксемия и рост в артериальной крови напряжения углекислого газа вследствие несоответствия патологически низкой альвеолярной вентиляции объемной скорости тока оксигенируемой смешанной венозной крови
Артериальная гипоксемия вследствие гиповентиляции обусловлена не только падением парциального давления кислорода в альвеолах, вызванного тем, что кислород уходит из необновляемой альвеолярной газовой смеси в смешанную венозную кровь. Одновременно в альвеолах растет парциальное давление углекислого газа, что служит еще одним фактором снижения парциального давления 02 в альвеолярной газовой смеси.
Если нет патологических изменений легких и дыхательных путей, то гиповентиляция является следствием: нарушений центральной регуляции внешнего дыхания, паралича или слабости дыхательных мышц (диафрагмы в особенности). Дыхательная недостаточность при закрытой травме груди отчасти обусловлена нарушением целостности каркаса грудной клетки и пневмотораксом. Причины гиповентиляции почти эквивалентны причинам респираторного ацидоза.
Рестриктивные расстройства внешнего дыхания при респираторном дистресс-синдроме взрослых и тяжелой пневмонии, снижая физиологическую площадь легочной мембраны, вызывают респираторный ацидоз и гиповентиляцию как причину артериальной гипоксемии. Физиологическая площадь легочной мембраны может быть снижена в результате аспирации воды при утоплении. Аспирация кислого желудочного содержимого после регургитации вызывает синдром Мендельсона, патогенез которого составляет острое воспаление в ответ на первичную альтерацию вследствие высокого содержания протонов в альвеолах, интерстиции и клетках респиронов.
Асцит и ожирение снижают дыхательный объем и нарушают равномерность альвеолярной вентиляции. В результате растет часть респиронов с вентиляцией, низкой относительно объемной скорости кровотока. Ожирение предрасполагает к падению физиологической площади легочной мембраны после полостных оперативных вмешательств не только через низкую податливость грудной клетки, но и являясь фактором риска ателектазов в послеоперационном периоде.
Угнетение активности нейронов дыхательного центра как причину гиповентиляции обуславливают:
побочные эффекты лекарственных средств;
черепно-мозговые ранения и травмы с эпидуральной и (или) субду- ральной гематомой;
злокачественные опухоли или их метастазы соответствующей локализации;
абсцессы мозга и менингит;
расстройства мозгового кровообращения и их следствия, инфаркт головного мозга и субарахноидальное кровоизлияние.
Причиной гиповентиляции могут быть нарушения сократительной способности дыхательных мышц в результате патологических изменений миоцитов или нарушений регуляции на уровне нейромышечного синапса. Способность миоцитов произвольных мышц к сокращению падает при таких заболеваниях как периодический паралич, а также вследствие выраженных гипокалиемии и гипофосфатемии. Ареактив- ность скелетных мышц к эфферентации на уровне синапса обуславливают миастения и такое заболевание как синдром Гийена-Барре. Кроме того, проведение нервного импульса через синапс к миоцитам блокируют лекарственные средства: миорелаксанты, антибиотики из группы аминогликозидов и др.
Наиболее частые в клинической практике причины низкого парциального давления кислорода во вдыхаемой газовой смеси, вызывающего артериальную гипоксемию, - это дефекты проведения искусственной вентиляции легких.
В остром периоде тяжелой раневой болезни циркуляторная гипоксия приводит к падению напряжения кислорода в смешанной венозной крови. Одновременно в легких может расти общий объем ее. Повышенное примешивание к артериальной крови смешанной венозной, напряжение кислорода в которой находится на патологически низком уровне, служит одной из причин артериальной гипоксемии после тяжелых ранений и травм.
РЕСПИРАТОРНЫЕ АЦИДОЗ И АЛКАЛОЗ
Респираторный ацидоз - это патологическое состояние вследствие роста концентрации протонов во внеклеточной жидкости и крови ([Н+]), обусловленное задержкой в организме углекислого газа из-за преобладания высвобождения С02 во внутреннюю среду при его образовании в ходе обмена веществ над выделением углекислого газа во внешнюю среду при внешнем дыхании. О респираторном ацидозе свидетельствуют pH артериальной крови на уровне более низком, чем нижний предел диапазона нормальных колебаний (7,38), при напряжении в ней углекислого газа большем, чем 43 мм рт. ст.
Ведущее звено патогенеза респираторного ацидоза - это снижете способности системы внешнего дыхания выделять углекислый газ во внешнюю среду. Его обуславливают нарушения регуляции в системе внешнего дыхания и повреждения болезнями и патологическими процессами ее эффекторов, снижающие через действие тех или иных механизмов очищение альвеолярной газовой смеси от двуокиси углерода.
Наиболее часто к респираторному ацидозу приводят:
Хронические заболевания легких, которые в основном характеризуют обструктивные расстройства внешнего дыхания. Следует заметить, что данные заболевания (бронхиальная астма и хронический обструктив- ный бронхит) приводят к респираторному ацидозу лишь при крайней степени обострения обструктивных расстройств альвеолярной вентиляции (внешнего дыхания), которое в частности происходит при астматическом статусе. При этом непосредственной причиной респираторного ацидоза является критическое снижение числа тех респиронов, в которых вентиляция достаточна для нормального очищения альвеолярных пространств от углекислого газа. Причиной тому служит патологический рост сопротивлений дыхательных путей респиронов, частей и отделов легких.
Падение силы сокращений дыхательных мышц в результате их патологических изменений и нарушения передачи возбуждения в нейро- мышечных синапсах (миастения, действие антидеполяризующих миоре- лаксантов). Слабость дыхательных мышц как причина респираторного ацидоза возникает при таких заболеваниях как синдром Гийена-Барре (острая идиопатическая демиелинизурующая полинейропатия), а также полимиозит и дерматомиозит. При ботулизме причина респираторного ацидоза - это падение альвеолярной вентиляции вследствие блокады под влиянием ботулинического экзотоксина высвобождения ацетилхолина из пресинаптических нервных окончаний в нервно-мышечном соединении. Действие аналогичного патогенетического механизма приводит к респираторному ацидозу у больных с синдромом Итона-Ламберта.
Угнетение функциональной активности инспираторных нейронов дыхательного центра как результат побочного действия наркотических анальгетиков и других лекарственных средств, расстраивающих центральную регуляцию внешнего дыхания.
При хроническом респираторном ацидозе, длительность которого превышает 48 ч, происходит полная мобилизация всех возможных механизмов компенсации, в результате которой почки начинают предельно интенсивно образовывать и задерживать в организме бикарбонатный анион. Поэтому при хроническом респиратором ацидозе в ответ на рост РаСОг концентрация бикарбонатного аниона в плазме крови растет в большей степени, и происходит меньшее снижение pH, чем при остром респираторном ацидозе.
Рост напряжения углекислого газа в артериальной крови до уровня более высокого, чем 60 мм рт. ст., (тяжелый респираторный ацидоз) служит абсолютным показанием к проведению искусственной вентиляции легких. Не следует ждать данных исследования кислотно-основного состояния и газов крови, если симптомы говорят о тяжелом респираторном ацидозе. О крайней степени тяжести респираторного ацидоза в частности свидетельствуют такие его симптомы, как сонливость и заторможенность. Они связаны с ростом давления спинномозговой жидкости, обусловленным увеличением мозгового кровотока в ответ на возрастание напряжения углекислого газа в артериальной крови. По мере прогрессирования респираторного ацидоза к его симптомам присоединяется артериальная гипотензия как следствие острой недостаточности кровообращения (схема 17.1).
Схема
17.1.
Патогенез недостаточности кровообращения
вследствие острого тяжелого респираторного
ацидоза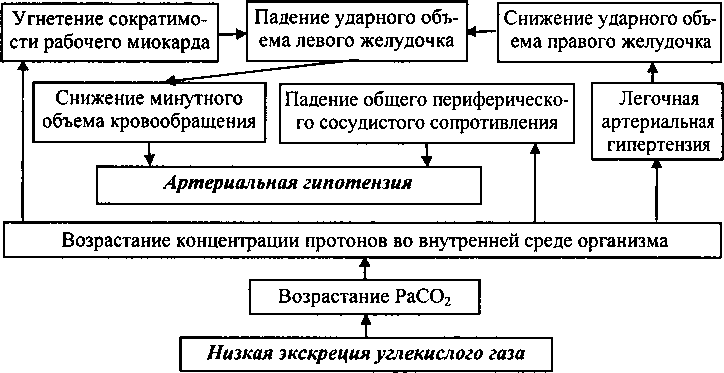
Респираторный алкалоз - это патологическое состояние вследствие избыточной относительно образования углекислого газа в ходе обмена веществ экскреции двуокиси углерода при внешнем дыхании. О развитии респираторного ацидоза свидетельствуют снижение напряжения углекислого газа в артериальной крови до уровня более низкого, чем 37 мм рт. ст., при возрастании pH до величин, превышающих 7,42.
Ведущее звено патогенеза респираторного алкалоза - это патогенно избыточное выведение углекислого газа системой внешнего дыхания. Метаболический алкалоз вызывается сдвигами регуляции внешнего дыхания и патологическими изменения ее эффекторов, которые повышают очищение альвеолярной газовой смеси от двуокиси углерода.
Наиболее частая причина острого респираторного алкалоза - это неврозы, при которых внутрицентральные отношения и регуляция внешнего дыхания расстраиваются таким образом, что система внешнего дыхания начинает избыточно элиминировать С02. Аномально повышенное выделение углекислого газа снижает его напряжение в артериальной крови, что в соответствии с уравнением Гендерсона-Гассельбаха уменьшает концентрацию протонов во внеклеточной жидкости, то есть вызывает респираторный алкалоз.
Гипервентиляционный синдром - это результат обострения невроза, при котором избыточная вентиляция легких обуславливает респираторный алкалоз. При этом гипервентиляция нарастает параллельно с возрастанием тревожности. Тревожность (немотивированное беспокойство) становится предельно выраженной и может трансформироваться сначала в заторможенность, а затем (у небольшой части больных) в состояние пре- комы. Прекому характеризует крайняя затрудненность еще возможного в отличие от комы контакта с пациентом. Падение насосной функции сердца как причина прекомы у больных с респираторным алкалозом возникает при росте pH артериальной крови до уровня 7,7 и выше. Респираторный алкалоз при гипервентиляционном синдроме приводит к снижению сократительной способности произвольных мышц, которое может обусловить острую мышечную слабость (ложные параличи). Из других жалоб больных с гипервентиляционным синдромом следует выделить ощущение затрудненности вдоха, головокружения без обморока, а также онемение рук и ног. Электроэнцефалографическим эквивалентом синдрома являются билатеральные синхронные тета-волны, которые сменяются дельта-волнами с периодическими пиковыми и медленными разрядами.
Отравление салицилатами приводит к респираторному ацидозу через состояние патологически усиленного возбуждения инспираторных нейронов дыхательного центра. Кроме того, хронически повышенный уровень возбуждения инспираторных нейронов может быть следствием нарушений мозгового кровообращения, опухолей головного мозга, инфекционных поражений центральной нервной системы, а также возникать в результате черепно-мозговых ранений и травм.
При синдромах (патологических состояниях) сепсиса и системной воспалительной реакции респираторный алкалоз - это следствие устойчивого возбуждения инспираторных нейронов, обусловленного супра- сегментарным эффектом цитокинов, вызывающих данные синдромы при циркуляции с кровью в повышенной концентрации (гиперцитоки- немия).
Артериальная гипоксемия любого происхождения может быть причиной респираторного алкалоза, который развивается из-за гипервентиляции в ответ на возбуждение периферических хеморецепторов вследствие падения напряжения кислорода в артериальной крови. Таков механизм развития респираторного алкалоза у больных с эмболией легочной артерии и ее ветвей, пневмонией, бронхиальной астмой и другими легочными заболеваниями. Кроме того, причиной респираторного алкалоза у больных с заболеваниями легких является возбуждение соответствующих рецепторов патологически измененных легочной паренхимы, бронхов и плевры, которое представляет собой стимул гипервентиляции.
Если у больных с респираторным алкалозом pH артериальной крови поднимается до уровня более высокого, чем 7,6, то для коррекции респираторного алкалоза может быть целесообразным дыхание газовыми смесями, обогащенными углекислым газом.
ПАТОГЕНЕТИЧЕСКИЕ ПРИНЦИПЫ ПРОВЕДЕНИЯ ИСКУССТВЕННОЙ ВЕНТИЛЯЦИИ ЛЕГКИХ
Искусственная вентиляция легких (ИВЛ) представляет собой крайне инвазивный элемент интенсивной терапии. Поэтому врачам, которым приходится прибегать к ИВЛ, необходимо четко представлять ее в патогенетическом отношении обоснованные цели:
/. Достижение адекватных потребностям организма оксигенации смешанной венозной крови и освобождения ее от углекислого газа Достижение данной цели ИВЛ предотвращает летальный исход, когда в результате типических патологических процессов, легочных заболеваний, а также нарушений регуляции внешнего дыхания (респираторный дист- ресс-синдром взрослых, астматический статус, побочный центральный депрессивный эффект наркотических анальгетиков и др.) поглощение кислорода легкими и экскреция углекислого газа падают до опасно низкого уровня. У многих больных с тяжелой артериальной гипоксемией начало ИВЛ позволяет достичь лишь минимально достаточного транспорта кислорода от легких на периферию и устранить респираторный ацидоз. Низкий уровень РаС>2 и патологически высокое РаС02 как показания к ИВЛ (табл. 17.3) свидетельствуют о критическом несоответствии угнетенной функции внешнего дыхания потребностям организма.
Таблица
17.3
Показатели
функции внешнего дыхания и легочного
газообмена как показания к началу ИВЛ
Показатель
Значения,
при которых необходимо начинать ИВЛ
Напряжение
кислорода в артериальной крови, мм
рт. ст.
<50
Напряжение
углекислого газа в артериальной
крови, мм рт. ст.
>55
Общее
(сумма анатомического, физиологического
и истинного) шунтирование смешанной
венозной крови, % от минутного объема
кровообращения
>20
Физиологическое
мертвое пространство, %
дыхательного объема
>60
Жизненная
емкость легких, мл/кг массы тела
<10
Уменьшение потребления кислорода организмом за счет почти пол- ного исключения или снижения уровня потребления свободной энергии при внешнем дыхании. Достижение данной цели позволяет снизить патогенное относительно насосной функции сердца возрастание минутного объема кровообращения. Снижение потребления кислорода организмом, обусловленное миоплегией при ИВЛ, может положительно сказаться на насосной функции сердца у больных с тяжелой сердечной недостаточностью. В остром периоде после тяжелых травм и у больных в других критических состояниях недостаточное поглощение кислорода легкими служит причиной респираторно-циркуляторной гипоксии, которую, кроме того, обуславливает повышенная потребность клеток в 02. К таким состояниям в частности относят тяжелые травматическую, раневую и ожоговую болезни, состояние после высокотравматичных оперативных вмешательств, а также сепсис и системную воспалительную реакцию. В результате преобладания потребления кислорода организмом (высокой потребности в 02) над его поглощением легкими и системным транспортом кислорода напряжение кислорода в артериальной крови падает, то есть развивается артериальная гипоксемия.
Артериальная гипоксемия в данном случае является результатом несоответствия поглощения кислорода легкими и системного транспорта кислорода высокой потребности организма в 02. Кроме того, артериальная гипоксемия как звено патогенеза респираторно-циркуляторной гипоксии через снижение насыщения кислородом гемоглобина обостряет кислородное голодание всего организма. Поэтому снижение потребления кислорода организмом после исключения работы мышц при внешнем дыхании может устранить респираторно-циркуляторную гипоксию или снизить степень ее тяжести. Под респираторно-циркуляторной гипоксией мы понимаем патологическое состояние вследствие недостаточных поглощения кислорода легкими и системного транспорта кислорода.
У больных с тяжелыми обструктивными расстройствами внешнего дыхания (астматический статус), а также в случае критического снижения физиологической площади легочной мембраны в результате рестриктивных расстройств (респираторный дистресс-синдром взрослых) артериальная гипоксемия служит стимулом компенсаторной гипервентиляции, которая вследствие высоких сопротивления дыхательных путей и низкой податливости легких приводит к особо выраженному росту работы мышц при внешнем дыхании. В результате в основном потребление кислорода всем организмом начинает составлять утилизация 02, которая происходит при биологическом окислении в мышцах, работающих для внешнего дыхания. У таких больных патогенно высокое потребление кислорода организмом служит ведущей причиной артериальной гипоксемии, а ИВЛ устраняет или уменьшает падение Ра02 в основном посредством снижения потребления кислорода при самостоятельном внешнем дыхании.
Несмотря на снижение работы сердца после устранения артериальной гипоксемии искусственной вентиляцией легких, эндотрахеальная интубация и длительная ИВЛ вызывают расстройства системного, легочного и периферического кровообращения (схема 17.2). Даже при близком к идеальному соблюдении правил асептики в отделениях интенсивной терапии, эндотрахеальная интубация и продленная ИВЛ всегда приводят к нозокомиальным легочным инфекциям. В этой связи следует рассматривать ИВЛ как вынужденную временную меру, а одной из задач интенсивной терапии считать создание предпосылок прекращения длительной искусственной вентиляции легких.
Длительную ИВЛ часто проводят у больных, находящихся в состоянии ускоренного голодания, которое характеризует интенсивное использование резервов протеинов для поддержания белкового синтеза в защитных системах (регуляции, иммунитета и пр.). Снижение интенсивности функционирования дыхательных мышц при длительной ИВЛ быстро переводит их в разряд депо интенсивно мобилизуемых белковых резервов, то есть служит причиной их дистрофии. Поэтому ИВЛ легче начать, чем прекратить без вреда для больного. В этой связи полноценное парентеральное или смешанное питание следует считать средством предупреждения дистрофии дыхательных мышц вследствие низкого уровня их работы при длительной ИВЛ.
Схема
17.2.
Патогенез расстройств кровообращения
вследствие ИВЛ и эндотрахеальной
интубации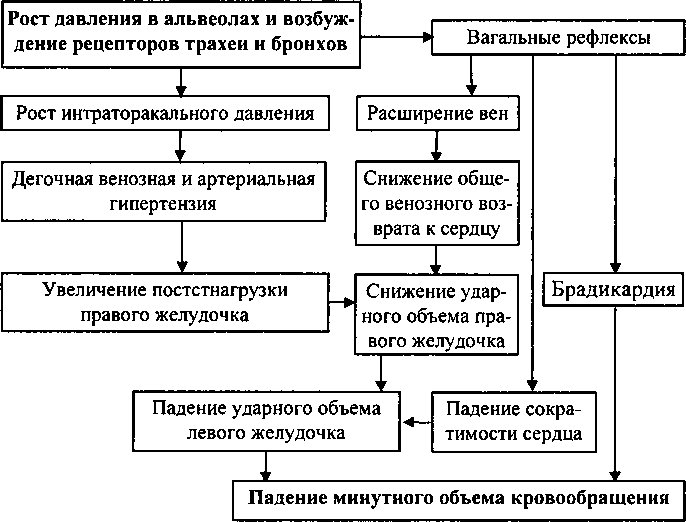
Быстро наступающую усталость (слабость) дыхательных мышц после прекращения длительной ИВЛ считают одной из основных причин ее возобновления. Слабость дыхательных мышц как следствие длительной ИВЛ - это результат не только атрофии дыхательных мышц, но и расстройств регуляции дыхательного акта. Нарушения регуляции предположительно можно связать с длительным извращением афферентации в системе внешнего дыхания при длительной ИВЛ. Нельзя исключить, что дизрегуляция дыхательного акта после длительной ИВЛ повышает потребление кислорода для самостоятельного внешнего дыхания, что повышает потребление кислорода всем организмом. Рост потребления кислорода через снижение напряжения кислорода в артериальной крови обуславливает необходимость возобновления ИВЛ.
Можно считать, что после определенного периода длительной ИВЛ возобновление естественного внешнего дыхания становится невозможным вследствие слабости дыхательных мышц. В этой связи становится ясной необходимость «переходного» режима ИВЛ, при котором работа дыхательных мышц несколько выше, чем при длительной ИВЛ, но остается сниженной. Кроме того, у больных с сердечной недостаточностью иногда полезно ограничить потребление кислорода организмом для меньшей работы сердца. Рациональным в таких случаях следует признать снижение высокого потребления кислорода при внешнем дыхании без значительного снижения работы дыхательных мышц. Сохранение определенного уровня работы дыхательных мышц необходимо для предотвращения их дистрофии вследствие длительной ИВ Л. Таким «переходным» режимом ИВЛ является вспомогательная искусственная вентиляция легких. В этом режиме каждая попытка самостоятельного вдоха запускает подачу вдыхаемой газовой смеси, которую аппарат искусственной вентиляции легких вдувает в легкие в заданном объеме. При снижении частоты дыхательных актов (ЧД) ниже определенного предела аппарат начинает работать как автомат с заданной частотой искусственных вдохов. Поскольку каждый вдох больного в режиме вспомогательной вентиляции дополняется или полностью обеспечивается респиратором, то работа дыхательных мышц невелика, хотя главная дыхательная мышца диафрагма продолжает сокращаться. Следует заметить, что увеличение ЧД у больных, которым проводят вспомогательную ИВЛ, через увеличение минутного объема альвеолярной вентиляции может привести к респираторному алкалозу.
ИВЛ в режиме прерывистой принудительной вентиляции является промежуточным этапом на пути к адекватному самостоятельному дыханию больного после вспомогательной ИВЛ. В таком режиме ИВЛ проводят больным, у которых самостоятельное дыхание через определенные промежутки времени ведет к утомлению дыхательных мышц и его следствию острой дыхательной недостаточности. Этот режим ИВЛ заключается в том, что через определенные временные интервалы аппарат ИВЛ начинает периодическую подачу вдыхаемой газовой смеси в легкие больного вне зависимости от его попыток сделать вдох. Периоды интенсивной работы всех дыхательных мышц в данном режиме устраняют или предотвращают их дистрофию. Кроме того, к преимуществам этого режима относят:
меньший риск развития дыхательного алкалоза, так как при данном режиме избыточная вентиляция легких практически невозможна;
при прерывистой принудительной вентиляции меньше суммарная длительность периодов положительного (выше атмосферного) ин- траторакального и интраальвеолярного давления и, соответственно, меньше отрицательное влияние ИВЛ на кровообращение;
меньшие дозы, а значит меньшие побочное действие и кумуляция седативных средств, наркотических анальгетиков и миорелаксантов.
Однако в клинической практике эти преимущества периодической принудительной вентиляции проявляют себя не всегда. Это связывают во- первых с тем, что аппарат ИВЛ часто начинает искусственную вентиляцию уже после того, как развились выраженная усталость дыхательных мышц и артериальная гипоксемия. В результате потребность дыхательных мышц в кислороде и энергопластических субстратах часто находится на патологически высоком уровне и остается неудовлетворенной. Это обостряет дистрофию мышц, участвующих в дыхательном акте, и тормозит возобновление полностью самостоятельного и адекватного внешнего дыхания.
У больных с диффузными патологическими изменениями легочной паренхимы (респираторный дистресс-синдром взрослых, пневмония) одним из звеньев патогенеза крайне тяжелых артериальной гипоксемии и острой дыхательной недостаточности является спадение респираторных бронхиол и альвеолярных мешков, выключающее респироны из легочного газообмена. Для возобновления вентиляции респиронов при ИВЛ увеличивают соотношение продолжительности фаз вдоха или выдоха от 1:2 до 1:1 - 4:1, что ведет к раскрытию респираторных бронхиол и альвеолярных мешков и улучшению легочного газообмена. С одной стороны, увеличение соотношения повышает вероятность отрицательных влияний искусственной вентиляции легких на кровообращение, так как увеличивает суммарную длительность периодов положительного интраторакаль- ного и интраальвеолярного давлений. С другой стороны, при данном соотношении фаз вдоха и выдоха снижается максимальное положительное инспираторное давление, и становится меньшим угнетение насосной функции сердца вследствие ИВЛ.
При высокочастотной ИВЛ вдыхаемая смесь подается с высокой частотой (60-3000 мин1) и с малым дыхательным объемом, составляющим 2-4 мл/кг. Речь в данном случае идет не о вентиляции легких в силу градиентов давлений между альвеолами и верхними дыхательными путями, а о продвижении «сотрясаемой» газовой смеси по дыхательным путям до респиронов подобно тому, как облако аэрозоля заполняет камеру его генератора. Поэтому считают, что из-за сложности работы с соответствующим аппаратом ИВЛ и не доказанной клинической эффективности данный режим ИВЛ может быть рекомендован только по жизненным показаниям, когда травма дыхательных путей или бронхоплевральный свищ обуславливают артериальную гипоксемию и неэффективность обычной ИВЛ в силу невозможности создания градиента давлений между альвеолами и дыхательными путями.
Так как гипоксемия более опасна, чем токсическое действие кислорода при кратковременной ИВЛ газовой смесью с высоким содержанием 02, то ИВЛ у больных с острой дыхательной недостаточностью начинают при концентрации кислорода во вдыхаемой газовой смеси, составляющей 90-100 %. Затем, исследуя напряжения кислорода и углекислого газа в артериальной крови и непрерывно проводя пульсоксиметрию, содержание кислорода во вдыхаемой газовой смеси (РЮ2) снижают не более, чем до 60 %, поддерживая напряжение кислорода в артериальной крови на уровне более высоком, чем 60 мм рт. ст.
При экстренном начале ИВЛ у больного с острой дыхательной недостаточностью минутный объем дыхания (вентиляции) должен находиться на уровне 100 мл/кг. Этого обычно достигают при ЧД равной 8-14 мин'1 и дыхательном объеме, составляющем 10-15 мл/кг. Затем МОД подбирают так, чтобы pH крови был в нормальных пределах. При этом не ориентируются на среднестатистическую норму диапазона изменений напряжения углекислого газа в крови здоровых людей. Так, РаС02 у больных с хроническими обструктивными расстройствами внешнего дыхания при
ИВЛ необходимо поддерживать в пределах, соответствующих состоянию хронической гипервентиляции в ответ на артериальную гипоксемию. К этому низкому уровню РаССЬ больные с хроническими обструктивными расстройствами вентиляции легких адаптированы через снижение образования бикарбонатного аниона почками и бикарбонатурию. Почки у таких пациентов переходят на стабильно отличный от обычного физиологического уровень синтеза и реабсорбции бикарбонатного аниона. Поэтому возвращение напряжения углекислого газа в артериальной крови в обычные «нормальные» пределы может привести к дыхательному ацидозу, так как почки некоторое время не смогут адекватно образовывать и задерживать бикарбонатный анион.
Желательно при проведении экстренной ИВЛ использовать дыхательный объем такой величины, при которой максимальное давление в дыхательных путях в фазу вдоха не превышает 40-50 см вод. ст. Это ограничение направлено на предотвращение падения насосной функции сердца через рост интраальвеолярного давления. Если необходимо увеличить объем искусственной альвеолярной вентиляции, то целесообразнее повысить дыхательный объем, чем увеличить ЧД, так как снижение дыхательного объема может привести к спадению и обтурации респираторных бронхиол и альвеолярных мешков. Тем самым увеличение ЧД исключит из участия в легочном газообмене часть респиронов и приведет к артериальной гипоксемии.
Положительное, то есть превышающее атмосферное, давление в конце выдоха (ПДКВ) сохраняет и увеличивает физиологическую площадь легочной мембраны, предотвращая спадение альвеол и расправляя спавшиеся альвеолы. Поэтому использование ПДКВ, которое больше атмосферного давления на 3-5 см вод. ст., при обычном режиме ИВЛ позволяет уменьшить содержание кислорода во вдыхаемой газовой смеси без снижения РаОг- ПДКВ при ИВЛ опасно падением насосной функции сердца, обусловленным ростом интраальвеолярного давления. Когда ПДКВ выше атмосферного давления на 15 см вод. ст., то резко возрастает риск баротравмы легких и пневмоторакса.
Кроме усталости (быстрого наступления слабости) дыхательных мышц причинами медленного перехода от длительной ИВЛ к адекватному самостоятельному внешнему дыханию служат:
хроническая легочная инфекция;
патологически высокая бронхиальная секреция;
бронхоспазм как причина обструктивного нарушения внешнего дыхания;
снижение минутного объема кровообращения, ограничивающее поступление смешанной венозной крови к респиронам на уровне всех легких.
Все эти патологические состояния тем или иным образом снижают физиологическую площадь легочной мембраны. Так легочная инфекция через воспаление выключает респироны из участия в легочном газообмене, что снижает физиологическую площадь легочной мембраны. Эту
площадь уменьшает, вызывая патологическую вариабельность вентиля- ционно-перфузионных отношений, и бронхоспазм, который вызывает патогенную вариабельность сопротивлений дыхательных путей респиронов, участков легочной ткани и отделов легких. По аналогичному механизму снижает площадь физиологической легочной мембраны и вариабельная, частичная или полная обтурация просвета дыхательных путей бронхиальным секретом. Низкий минутный объем кровообращения ведет к недостаточной оксигенации смешанной венозной крови, приводя на уровне всех легких к низкому относительно вентиляции кровоснабжению респиронов смешанной венозной кровью, то есть, снижая физиологическую площадь легочной мембраны. Снижение физиологической площади легочной мембраны как причина артериальной гипоксемии приводит к компенсаторной гипервентиляции и ее следствию, быстрому наступлению усталости дыхательных мышц, еще не окрепших после длительной ИВЛ.
Патологические изменения легких и дыхательных путей как причины задержки восстановления адекватного самостоятельного дыхания после длительной ИВЛ обуславливают повышенную работу мышц для внешнего дыхания не только в результате компенсаторной гипервентиляции в ответ на снижение физиологической площади легочной мембраны, вызывающего артериальную гипоксемию. Так, рост сопротивления дыхательных путей вследствие бронхоспазма, их полной или частичной закупорки секретом повышает работу дыхательных мышц во много раз, что обуславливает быстрое развитие их усталости после прекращения длительной ИВЛ и необходимость ее возобновления вскоре после экстубации. Следует заметить, что повторная интубация трахеи через вагальные рефлексы обостряет бронхоспазм, что еще в большей степени задерживает восстановление незатрудненного самостоятельного дыхания.
