
- •Міністерство освіти і науки України Сумський державний університет машинобудівний коледж
- •Розділ і. Хімічна термодинаміка
- •1Фізична хімія як розділ хімії. Термодинаміка.
- •2Основні термодинамічні поняття:
- •2.1. Термодинамічні системи та їх класифікації
- •Контрольні запитання:
- •3Термохімія. Основні поняття термохімії.
- •Контрольні запитання:
- •4Поняття про ентропію та енергію Гіббса.
- •Контрольні запитання:
- •5Термодинамічні потенціали та умови спонтанності протікання процесів.
- •Контрольні запитання:
- •6Константа хімічної рівноваги.
- •Контрольні запитання:
- •7Хімічна рівновага в гетерогенних системах
- •Контрольні запитання:
- •8Фазова рівновага.
- •Контрольні запитання:
- •Розділ ііі. Хімічна кінетика
- •9Кінетика. Поняття про швидкість реакції.
- •10Фактори, що впливають на швидкість реакції
- •2.1. Концентрація реагуючих речовин
- •2. Фактори, що впливають на швидкість реакції:
- •Контрольні запитання:
- •11Поняття молекулярності реакції.
- •12Порядок реакції. Класифікація реакцій за порядком.
- •Контрольні запитання:
- •13Диференціальні способи визначення порядку реакції
- •14Інтегральні способи визначення порядку реакції
- •Контрольні запитання:
- •Диференціальні способи визначення порядку реакції.
Контрольні запитання:
Що називається фазовою рівновагою?
Рівновага між конденсованою і газоподібною фазами.
Умова фазової рівноваги в системі, яка складається з декількох конденсованих фаз і декількох компонентів.
Що називається числом незалежних компонентів?
Правило фаз.
Класифікація систем за ступенем свободи.
Діаграма стану води.
Рівняння Клазіуса-Клайперона.
Література: Киреев В.А. Краткий курс физической химии. – М.: «Химия», 1969. - §§ 88-92, с. 242-258.
Розділ ііі. Хімічна кінетика
Тема: Енергія активації. Швидкість хімічної реакції.
План
9Кінетика. Поняття про швидкість реакції.
10Фактори, що впливають на швидкість реакції
2.1. Концентрація реагуючих речовин
2.2. Температура і природа реагуючих речовин
2.3. Наявність каталізатора
1. Розділ хімії, що вивчає швидкість хімічних реакцій, називається хімічною кінетикою.
Якщо реакція відбувається в гомогенній системі, то вона проходить у всьому об’ємі цієї системи. Якщо реакція відбувається між речовинами, що утворюють гетерогенну систему, то вона може проходити тільки на поверхні поділу фаз, що утворюють систему. У зв’язку з цим швидкість гомогенної реакції і швидкість гетерогенної реакції визначаються по-різному.
Швидкістю гомогенної реакції називається: 1) кількість речовини, що вступає в реакцію або утворюється під час реакції за одиницю часу в одиниці об’єму системи
2) Швидкістю реакції в гомогенній системі називається зміна концентрації будь-якої з речовин, що вступають у реакцію або утворюються під час реакції, що відбувається за одиницю часу.
![]() або
або
![]() ,
,
де ΔС – зміна концентрації; Δn – зміна кількості речовини; Δt – зміна часу; V – об’єм системи.
Швидкістю гетерогенної реакції називається кількість речовини, що вступає в реакцію або утворюється під час реакції за одиницю часу на одиниці поверхні фази.
![]() ,
де S – площа поверхні фази, на якій
відбувається реакція
,
де S – площа поверхні фази, на якій
відбувається реакція
2. Фактори, що впливають на швидкість реакції:
Природа реагуючих речовин;
Концентрація речовин;
Температура;
Наявність у системі каталізаторів
2.1. Необхідною умовою, щоб між частинками вихідних речовин відбулася хімічна взаємодія, є їхнє зіткнення одна з одною. Тому швидкість реакції пропорційна числу зіткнень, яких зазнають молекули реагуючих речовин.
Число зіткнень тим більше, чим вища концентрація кожної з вихідних речовин, або те саме, чим більший добуток концентрацій реагуючих речовин. Так, швидкість реакції А + В → С пропорційна добутку концентрації речовини А на концентрацію речовини В. Позначаючи концентрації речовин А і В відповідно через [А] і [В], можна написати:
υ = k[А][В], де
k – коефіцієнт пропорційності, що називається константою швидкості реакції.
Аналогічно, для реакції 2А + В → С можна написати υ = k[А][А][В] = k[А]2[В].
Викладені міркування підтверджуються законом діючих мас (закон Гульдберга-Вааге): При сталій температурі швидкість хімічної реакції пропорційна добуткові концентрацій реагуючих речовин, причому кожна концентрація входить у добуток в степені, що дорівнює коефіцієнту, який стоїть перед формулою речовини в рівнянні реакції.
Щоб дістати рівняння закону діючих мас, напишемо рівняння хімічної реакції в загальному вигляді: aA + bB + …→ …
Тоді за законом діючих мас можна записати у формі:
υ = k[А]a[В]b…
У випадку гетерогенних реакцій у рівняння закону діючих мас входять концентрації тільки тих речовин, які перебувають в газовій фазі або в розчині. Концентрація речовини, що перебуває в твердій фазі, звичайно є сталою величиною і тому входить у константу швидкості.
Величина константи швидкості залежить від природи реагуючих речовин, температури і наявності каталізаторів, але не залежить від концентрацій речовин.
2.2. Якщо скористатися результатами підрахунків, то виявиться, що число зіткнень між молекулами речовин за звичайних умов таке велике, що всі реакції мають відбуватися практично миттєво. Але не всі реакції закінчуються швидко. Цю суперечність можна пояснити, припустивши, що не всяке зіткнення речовин приводить до утворення продукту реакції. Щоб сталася реакція, треба спочатку розірвати або ослабити зв’язки між атомами в молекулах вихідних речовин, а на це потрібно затратити певну енергію.
Енергія активації – це надлишкова кількість енергії, яку повинні мати молекули у момент зіткнення, щоб прореагувати. Ця надлишкова енергія може бути у молекулах у різних формах. Це може бути:
підвищена кінетична енергія поступового або обертального руху молекули;
підвищена енергія внутрішньомолекулярних коливань атомів;
підвищена енергія руху електронів тощо.
Відомо, що швидкість більшості хімічних реакцій збільшується з підвищенням температури. Кількісно вплив температури на швидкість реакції можна оцінити двома шляхами.
Для реакцій у розчинах, що проходять за порівняно невеликих температур, можна використовувати напівкількісне емпіричне правило Вант-Гоффа.
Правилом Вант-Гоффа:
При підвищенні температури на кожні 10°С швидкість реакції зростає в 2-4 рази.
Математичний вираз правила Вант-Гоффа:
![]()
γ- температурний коефіцієнт; Т1 і Т2 – початкова і кінцева температури
Температурний коефіцієнт швидкості реакції – число, що показує, у скільки разів зростає швидкість певної реакції при підвищенні температури системи на 10 градусів
Більш точно і науково обґрунтовано вплив температури на швидкість реакції описує теорія активних зіткнень, основи якої запропонував шведський вчений С. Арреніус (1889р.). Сутність цієї теорії викладена в трьох положеннях:
Для того щоб прореагувати, молекули реагентів повинні зіткнутися.
Щоб зіткнення частинок дійсно привели до хімічного перетворення, надлишкова енергія молекул, які зіштовхуються, повинна перевищувати енергію активації, тобто молекули реагентів повинні подолати деякий потенціальний бар’єр.
Молекули перед зіткненням повинні бути зорієнтовані одна відносно іншої в просторі певним чином, тобто повинні утворювати конфігурацію, яка найбільш придатна для розриву одних зв’язків та виникнення інших.
Рівняння Арреніуса:
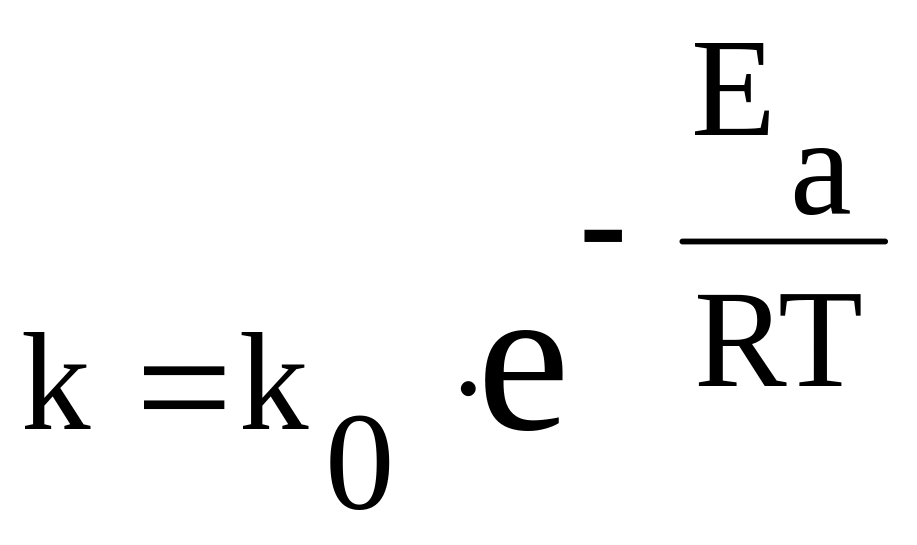
де k0 – перед експоненціальний множник (стала величина),
R – універсальна газова стала (8,314 Дж/моль∙К)
T – температура, К
Eа – енергія активації (кДж/моль)
Спочатку відбувається розрив або ослаблення зв’язків між атомами, при цьому речовини переходять у нестійкий проміжний стан, що характеризується великим запасом енергії. Цей стан називається активованим комплексом, який розпадається з утворенням продуктів реакції.
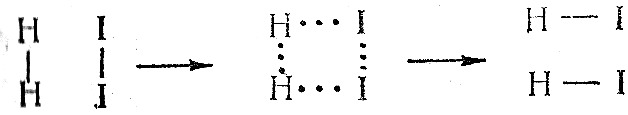
вихідні перехідний продукти
речовини стан реакції
(активований комплекс)
2.3. Речовини, що не витрачаються в результаті проходження реакції, але не впливають на її швидкість, називаються каталізаторами. Явище зміни швидкості реакції під дією каталізаторів називається каталізом.
У більшості випадків дія каталізаторів пояснюється тим, що він знижує енергію активації реакції. При наявності каталізатора реакція проходить через інші проміжні стадії, при чому ці стадії енергетично більш доступні..
