- •Методичні вказівки
- •Методичні вказівки
- •Лабораторна робота № 1 Тема роботи: Реакції галогенування. Добування галогенопохідних із спиртів.
- •І. Теоретична частина
- •Іі. Експериментальна частина
- •4.Розрахунок рецептури :
- •Результати розрахунку рецептури
- •6.Хід роботи
- •7.Спостереження
- •8.Розрахунок виходу
- •Примітки
- •Техніка безпеки
- •Контрольні запитання
- •Лабораторна робота № 2 Тема роботи: Реакції ацилювання.
- •І. Теоретична частина
- •Іі. Експериментальна частина
- •2.Побічні реакції:
- •3. Фізико-хімічні константи речовин
- •Розрахунок рецептури :
- •Результати розрахунку рецептури
- •5. Схема приладу
- •6. Хід роботи
- •7. Спостереження
- •8. Розрахунок виходу
- •Примітки
- •Техніка безпеки
- •Контрольні запитання
- •Лабораторна робота № 3 Тема роботи: Реакції ацилювання.
- •І. Теоретична частина
- •Іі. Експериментальна частина
- •3. Фізико-хімічні константи речовин
- •4.Розрахунок рецептури :
- •Результати розрахунку рецептури
- •8. Розрахунок виходу
- •Примітки
- •Техніка безпеки
- •Контрольні питання
- •Лабораторна робота № 4 Тема роботи: Відновлення ароматичних нітросполук.
- •І. Теоретична частина
- •Іі. Експериментальна частина
- •3. Фізико-хімічні константи речовин
- •4.Розрахунок рецептури :
- •Результати розрахунку рецептури
- •5.Схема приладів
- •6.Хід роботи
- •7.Спостереження
- •8. Розрахунок виходу:
- •Примітки
- •Техніка безпеки
- •Контрольні запитання
- •Лабораторна робота № 5 Тема роботи: Ацилювання. Реакція естерифікації.
- •І. Теоретична частина
- •Іі. Експериментальна частина
- •3. Фізико-хімічні константи речовин
- •Розрахунок рецептури :
- •7. Спостереження
- •8. Розрахунок виходу
- •Примітки
- •Техніка безпеки
- •Контрольні питання
- •3. Фізико-хімічні константи речовин
- •4. Розрахунок рецептури:
- •Результати розрахунку рецептури
- •5. Схеми приладів
- •7. Спостереження
- •8.Розрахунок виходу
- •Примітки
- •Техніка безпеки
- •Контрольні запитання
- •Лабораторна робота № 7 Тема роботи: Реакції електрофільного заміщення. Добування ароматичних галогенопохідних.
- •І. Теоретична частина
- •Іі. Експериментальна частина
- •4.Розрахунок рецептури :
- •Результати розрахунку рецептури
- •6.Хід роботи
- •7.Спостереження
- •8. Розрахунок виходу
- •Примітки
- •Техніка безпеки
- •Контрольні питання
- •Лабораторна робота № 8 Тема роботи: Реакції діазотування та азосполучення.
- •Іі. Експериментальна частина
- •3. Фізико-хімічні константи речовин
- •4.Розрахунок рецептури :
- •Результати розрахунку рецептури
- •5.Хід роботи
- •7.Розрахунок виходу
- •Примітки
- •Т ехніка безпеки
- •Контрольні питання
- •Лабораторна робота № 9 Тема роботи: Реакції діазотування та азосполучення.
- •І. Теоретична частина
- •Іі. Експериментальна частина
- •2.Побічні реакції:
- •4.Розрахунок рецептури :
- •Результати розрахунку рецептури
- •5.Хід роботи
- •7.Розрахунок виходу
- •Примітки
- •Контрольні питання
- •Література
4.Розрахунок рецептури :
а) за методикою взято:
КBr - 100 г, або 100/119,01 = 0,840 моль;
C2H5OH - 110 мл, або 110 . 0,789 = 86,79 г, або 86,79 / 46,07=1,884 моль;
H2SO4 - 110 мл, або 110 . 1,84 = 202,4, або 202,4 / 98,01 = 2,065 моль;
Н2О - 75 мл, або 75/18 = 4,16 моль.

Аналогічно: К надл.сірчаної = 2,065 / 0,840 = 2,458;
кислоти
В розрахунках коефіцієнт надлишку визначати до четвертої значущої цифри. Перевірку отриманих даних провести за пропорцією.
б) для даного досліду :
Розглянемо приклад: дано КВr 23 г. Визначаємо кількість моль КВr : 23 /119,01=0,193 моль. Знаходимо необхідну кількість моль C2H5OH, врахо-вуючи коефіцієнт надлишку - 0,193 .2,243=0,433 моль, або у грамах 0,433 . 46,07=19,95 г, або 19,95 /0,789= 25,28 мл ~25,3 мл. Аналогічно для H2SO4 – 0,193 .2,457 =0,475 моль, або 0,475 . 98,01= 46,55 г, або 46,55 / 1,84 =25, 3 мл. Необхідну кількість води розраховуємо за пропорцією: 100 г КВr - 75 мл, 23 г - Х. Звідки Х = (23 . 75)/ 100= 17,2 мл |
Дано: КВr г.
Необхідна кількість C2H5OH
Необхідна кількість Н2SO4
Необхідна кількість води |
Результати розрахунку рецептури
Речовина |
За методикою |
Коефіцієнт |
Для даного досліду |
||||
|
мл |
г |
моль |
надлишку |
мл |
г |
моль |
КВr |
- |
100 |
0,840 |
- |
- |
|
|
C2H5OH |
110 |
86,9 |
1,884 |
2,243 |
|
|
|
H2SO4 |
110 |
202,4 |
2,065 |
2,458 |
|
|
|
Н2О |
75 |
75 |
4,16 |
- |
|
|
|
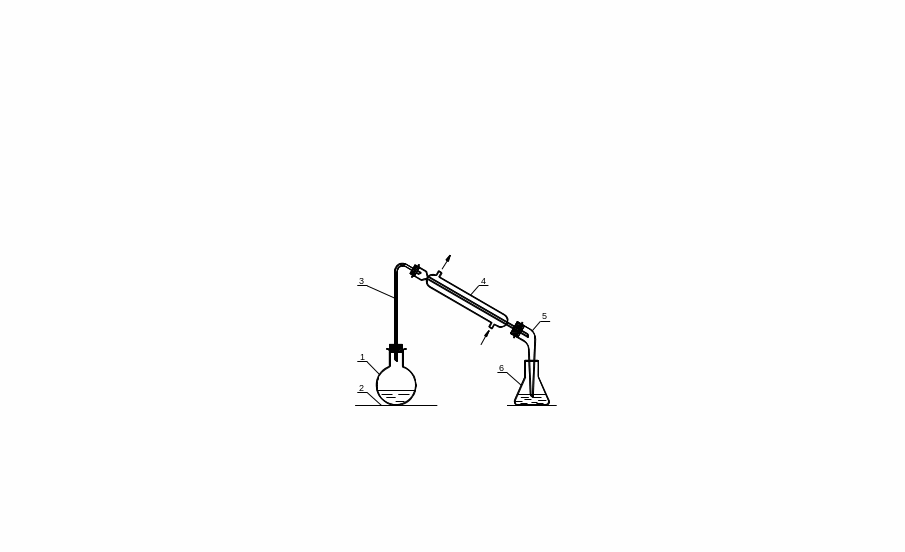
5.Схема приладів
Рис.1.Прилад для добування етилброміду: 1-реакційна колба; 2 - азбестова сітка; 3 -зігнута трубка; 4 - водяний холодильник; 5 - алонж; 6 – приймач
|
Рис.2. Прилад для перегонки етилброміду
|
6.Хід роботи
1.Для
проведення роботи збирають прилад (
рис.1). На одному штативі закріплюють
кільце з азбестовою сіткою, безпосередньо
над сіткою - реакційну колбу ( зазір між
колбою і азбестовою сіткою 0.5 см ). Колбу
з,єднують
з зігнутою трубкою. На іншому штативі
встановлюють холодильник, який обережно
з,єднують
з зігнутою трубкою. До холодильника
приєднують алонж, а потім встановлюють
приймач, в який наливають воду, кінчик
алонжа повинен бути занурений на 1-2 см
у воду
![]() .
(Розбирати прилад потрібно у зворотному
напрямку).
.
(Розбирати прилад потрібно у зворотному
напрямку).
2.В
круглодонну колбу наливають сірчану
(сульфатну) кислоту і при постійному
перемішуванні додають спирт
![]() .
.
3.Охолоджують
реакційну суміш під краном до кімнатної
температури і додають порціями необхідну
кількість води
![]() .
.
4.Подрібнений бромід калію вносять в колбу і приєднують її до приладу.
5.
Нагрівають обережно до кипіння на
азбестовій сітці, регулюючи нагрів так,
щоб реакційна маса при спінюванні не
потрапляла до холодильника
![]() .
.
6.Відганяють етилбромід поки він не перестане опускатися на дно у вигляді важких маслянистих крапель.
7.Відставляють приймач, реакційній масі у колбі дають трохи охолонути і переливають ще теплий розчин КНSO4 у сірчаній кислоті до порцелянової чашки для кристалізації.
8.Висушують
і збирають прилад для перегонки (Рис.2).
В колбу Вюрца поміщають невелику
кількість CaCl2![]() ,
сухий
приймач зважують разом з корком.
,
сухий
приймач зважують разом з корком.
9.Перевіряють ділильну лійку на герметичність, переливають до неї вміст приймача і відділяють нижній шар етилброміду безпосередньо у колбу Вюрца.
10.Переганяють його на нагрітому до 60ОС водогрії, збирають етилбромід у приймач, який охолоджують зовні льодом.
11.Зважують і розраховують вихід продукту.
12.Кристали КНSO4 відфільтровують через скляний фільтр та перекристалізовують із води ( інколи цю операцію не проводять, а зливають неповністю охолоджений залишок із реакційної колби у спеціальний посуд, який знаходиться у витяжній шафі) .