
- •Тема № 1. Классы неорганических соединений………………………….………..4
- •Тема 1. Основные классы неорганических соединений
- •1. Оксиды
- •2. Кислоты
- •3 . Основания и амфотерные гидроксиды
- •1. По числу гидроксильных групп (он−1):
- •2 Растворимые щёлочи .По степени растворимости в воде:
- •1. Средние
- •2. Кислые
- •3. Основные
- •6. Комплексные Состоят из сложного комплекса – внутренней сферы, которая заключена в квадратные скобки, и внешней сферы.
- •4. Двойные
- •5. Смешанные
- •6. Ионные уравнения реакций.
- •7. Генетическая связь между классами неорганических соединений.
- •Основный оксид
- •Основание
- •Кислота
- •Тема 2. Строение атома
- •Электронная структура многоэлектронных атомов
- •Алгоритм
- •5. Приведем примеры соединений в устойчивых степенях окисления (простое вещество, оксиды и гидроксиды см. П.11)
- •Тема 3. Ковалентная химическая связь
- •Алгоритм
- •Тема 4. Энергетика химических реакций
- •Х имические реакции
- •Протекают с выделением тепла Протекают с поглощением тепла
- •Первое следствие из закона Гесса:
- •С истемы
- •Изолированная Открытая
- •Тема 5. Химическая кинетика (скорость протекающих химических реакций)
- •Х имические реакции
- •Химические реакции
- •Тема 6. Способы выражения концентрации растворов
- •Массовая доля растворённого вещества
- •Молярная концентрация раствора
- •Моляльная концентрация раствора
- •Молярная концентрация эквивалента
- •Закон эквивалентов
- •6. Перевод одного способа выражения концентрации раствора в другой.
- •Тема 7. Физико-химические свойства растворов неэлектролитов
- •II закон рауля
- •Тема 8. Растворы электролитов ионные уравнения реакций
- •Э лектролиты
- •Выводы:
- •Выводы:
- •Алгоритм
- •Тема 9. Гидролиз солей
- •Основание
- •Кислоты
- •Алгоритм вывода константы гидролиза (Кг) соли Na2co3 (по 1 ступени)
- •Тема 10. Окислительно-восстановительные реакции
- •С.О. Можно определить:
- •Окислители:
- •Подбор коэффициентов в о.В.Р. Методом электронного баланса.
- •Алгоритм
- •Подбор коэффициентов ионно-электронным методом (метод полуреакций) Алгоритм
- •Кислая среда
- •Щелочная среда
- •Нейтральная среда
- •Расчёт э.Д.С.
- •Тема 11. Гальванические элементы (г.Э.) химические источники тока (х.И.Т.)
- •Выводы:
- •Алгоритм
- •Тема 12. Электролиз
- •Э лектролиз
- •Электролиз расплавов солей
- •Электролиз растворов солей
- •К атод: (вос-е) Анод: (ок-е)
- •Выводы:
- •Алгоритм
- •Тема 13. Электрохимическая коррозия металлов
- •К ислородная деполяризация
- •Выводы:
- •Алгоритм
- •Окончание таблицы 1
- •Электродные потенциалы металлов в различных средах
- •Перенапряжение выделения водорода и ионизации кислорода на
- •Список литературы:
- •Учебное издание
Алгоритм
Найдём центральный атом (ц.а.) в молекуле – тот атом, степень окисления которого выше независимо от знака.
Н2+О-2 => ц.а. – О (ст.ок.) = -2 => в атоме 2 неспаренных ē.
Определим число периферийных атомов (Н) – координационное число (к.ч.), которое указывает на число σ-связей.

2 . К.ч.(О) = 2 => 2 σ-связи. σ О σ Н
Н
Составим графическое изображение валентных электронов ц.а. в соответствующей степени окисления.


3. 8О 1s22s22p4
IIп. VIA вал. ē
2p
-
↑↓
↑
↑
↑↓
2s
Определим тип гибридизации, помня, что в гибридизации участвуют только те валентные А.О., которые образуют σ-связи (орбитали с неспаренными электронами, а также орбитали со спаренными электронами последнего энергетического уровня (Э.У.). На графическом изображении, пользуясь правилом 4 отсечём соответствующие А.О.
-
↑↓
↑ ↓
↓
↑
↑

2p
2s Тип гибридизации sp3
2 σ


Изобразим гибридизацию рисунком (см. табл. п.3).



 р
р



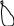
 +
p → → O
+
p → → O

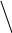 s
p
s
p


П
 окажем
перекрывание А.О. ц.а. – О – с переферийными
атомами – Н (помня, что от него в
образовании связей участвуют 1s1
орбитали.
окажем
перекрывание А.О. ц.а. – О – с переферийными
атомами – Н (помня, что от него в
образовании связей участвуют 1s1
орбитали.




O






H


H
Изобразим геометрию частицы (см. табл.1 п.3).



 O
O
H H
Угловая молекула
Тема 4. Энергетика химических реакций
Таблица 7

-
Термохимия – изучает тепловые эффекты химических реакций (первый и второй законы термодинамики)
Тепловой эффект химической реакции – тепло, которое выделяется или поглощается в данной химической реакции.
Система – совокупность частиц, веществ, находящихся во взаимодействии, мысленно или фактически обособленных от окружающей среды.
П ервый
закон термодинамики:
ервый
закон термодинамики:
“Тепло, сообщаемое системе (Q) расходуется на изменение её внутренней энергии (U) и на совершение работы против сил внешнего давления (А).
Q = U + A
Q = U
+ р
*V
,где А = р *V

Система перешла из состояния 1 в состояние 2
U1,
V1,
p1
U2,
V2,
p2
с остояние
1 состояние 2
остояние
1 состояние 2
начальное конечное
