
- •Лабораторный практикум
- •Технологиях”
- •Библиографический список
- •4. Зависимость потенциала металла от характера cреды.
- •Содержание
- •Потенциостатический метод изучения коррозионного поведения конструкционных материалов
- •3. Обработка опытных данных
- •3. Обработка опытных данных
- •Защита стали от коррозии лакокрасочными покрытиями
- •1. Теоретическая часть
- •Пассивность стали
- •1. Теоретическая часть
- •2. Аппаратура и методика работы
- •2. Экспериментальная часть
- •Вариант 2 Анодное пассивирование стали в 1-н. H2so4
- •3. Обработка опытных данных
- •Замедлители коррозии конструкционных материалов в кислотах
- •1. Теоретическая часть
- •Контактная коррозия металлов
- •1. Теоретическая часть
- •2. Аппаратура и методика работы
- •Кислотостойкость сплавов
- •1. Теоретическая часть
2. Аппаратура и методика работы
Вариант 1 Пассивирование стали в HNO3
(производится в вытяжном шкафу)
Четыре образца из углеродистой или низколегированной стали ( по указанию преподавателя) зачищают наждачной бумагой обезжиривают окисью магния и промывают. В пять химических стаканов или пробирок наливают растворы HNO3 различной концентрации (20, 30, 40, 50 и 60 %).
а. Определение пассивирующей концентрации HNO3
Один сухой стальной образец на изолированной проволоке поочередно погружают в стаканы с растворами HNO3, начиная с 20 %-ной концентрации и кончая 60 %-ной с выдержкой при концентрации 20, 30, 40 и 50 % по 10 сек. После этого образец оставляют в 60 %-ном растворе HNO3. При каждом погружении образца в очередной раствор HNO3 наблюдают за скоростью растворения в нем стали по газовыделению и отмечают концентрацию кислоты, при которой наступает пассивность стали - прекращение выделения пузырьков газа и окрашенных продуктов реакции на поверхности образца. Результаты наблюдений (заметное растворение, энергичное растворение, наступление пассивности, цвет продуктов коррозии и газов) записывают в табл. 1 (опыты 1 - 5).
б. Наблюдение устойчивости пассивного состояния стали
Извлекают образец стали из 60 %-ной HNO3 и погружают на 10 сек в 50 %-ную, затем в 40-, 30- и, наконец, 20 %-ную HNO3 (образец оставляют в последнем стакане). Наблюдают за поведением образца (растворяется или не растворяется) в каждом растворе и записывают результаты наблюдений в табл. 1 (опыты 6 - 9).
11
в. Депассивация стали
Стальной образец, не вынимая из 20 %-ной HNO3, приводят в соприкосновение на несколько секунд с зачищенным ранее вторым (незапассивированным) образцом стали, опуская последний на изолированной проволоке в раствор. Удалив затем из раствора незапассивированный образец, наблюдают за поведением основного образца (растворяется или не растворяется) в 20 %-ной HNO3. Результаты наблюдений записывают в табл. 1 (опыт 10).
г. Определение электродного потенциала образцов стали в активном и пассивном состоянии
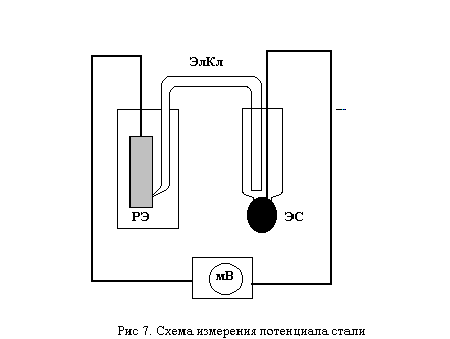
РЭ -рабочий электрод; ЭС - электрод сравнения; ЭлКл - элект-ролитический ключ; мВ - иономер-милливольтметр
Закрепляют третий образец стали в клемме держателя, погружают наполовину в непассивирующий (20 %-ный) раствор HNO3 и, одновременно, опустив в этот же раствор кончик промежуточного электролитического ключа, измеряют иономером-миливольтметром потенциал образца относительно насыщенного хлорсеребряного электрода сравнения (рис. 3).
Затем повторяют опыт с четвертым образцом в пассивирующем (определенном в предыдущих опытах) растворе HNO3, записывают в табл. 2 измеренные значения электродных потенциалов активного и пассивного образцов стали и пересчитывают их значения на водородную шкалу по-
12
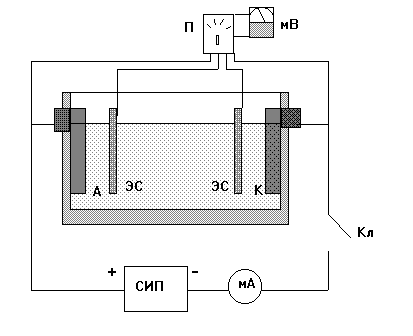
Рис. 8. Электрическая схема установки
А - анод; К - катод; ЭС - электрод сравнения; мА - миллиампер-
метр; СИП - cтабилизированный источник питания; мВ - ионо-
мер-милливольтметр; П - переключатель.
двух образцов для электрохимических испытаний, измеряют ее, обезжиривают окисью магния и вставляют в прорезь ячейки. Затем наливают в ячейку определенное количество кислоты без замедлителя и после пятиминутной выдержки измеряют начальные потенциалы электродов в данном растворе с помощью милливольтметра ( мВ).
Включив стабилизированный источник питания (СИП), устанавливают в цепи ток, равный 1,0 мА, и через 1 мин измеряют и записывают в табл. 2 потенциалы анода, катода и показания миллиамперметра (мА). Последовательно увеличивают силу тока цепи до 2,0; 5,0; 10,0; 15,0 и 20,0 мА, измеряя и записывая каждый раз после минутной выдержки потенциалы катода, анода и величину тока в цепи.
После окончания измерения кислоту выливают в бутыль для слива кислот, сосуд промывают водой, образцы зачищают наждачной бумагой и обезжиривают органическим растворителем. Затем производят аналогичные измерения в кислоте с замедлителем.
29
талла в растворе с замедлителем и без него, позволяет выяснить, какой процесс преимущественно тормозится при введении данного замедлителя.
Эффективность действия замедлителя (в процентах) выражается следующим соотношением:
z = ( K0 - K1 ) / K0 * 100, (12)
где z - защитное действие, %;
Ко - скорость растворения металла в среде без замедлителя, г/(м2.ч);
К1 - скорость растворения металла в среде с замедлителем, г/(м2.ч).
Действие замедлителя может характеризоваться защитным эффектом , равным
(13)
где К0 и К1 - то же, что в формуле (12).
