
- •1 Основные положения теории радикально цепного механизма реакций термического распада углеводородов (Теория Райса).
- •2. Механизм термического крекинга нормального бутана.
- •3. Превращение различных углеводородов при термическом крекинге.
- •4. Влияние температуры, продолжительности и давления на результаты термического крекинга.
- •5. Висбрекинг. Назначение, сырье, получаемые продукты, условия процесса. Варианты технологических схем процесса.
- •6.Варианты технологических схем висбрекинга. Их сопоставление
- •2 Установка висбрекинга с выносной адиабатической камерой.
- •7. Общая характеристика характеристика каталитического крекинга. Назначение, сырье, получаемые продукты, их применение. Условия процесса. Катализаторы. Варианты технологических схем.
- •Катализаторы крекинга. Разновидности, состав, каталитические и физические свойства, марки. Природа их каталитической активности.
- •9. Природа каталитической активности катализаторов крекинга. Пути образования ионов карбения из различных углеводородов.
- •Свойства ионов карбения.
- •11Химия каталитического крекинга.
- •12.Влияние качества сырья на результаты каталитического крекинга. Способы подготовки сырья крекинга.
- •Влияние температуры и объемной скорости на результаты кк.
- •14Влияние кратности циркуляции катализатора на результаты каталитического крекинга.
- •15.Регенерация катализаторов крекинга. Химические основы регенерации. Влияние условий процесса на скорость и глубину регенерации.
- •Технологическая схема установки каталитического крекинга с циркулирующим шариковым катализатором г-43-102. Условия процесса.
- •Тех схема установки каталитического крекинга с псевдоожиженным слоем катализатороа 1 а/1 м .
- •Блок-схема установки каталитического крекинга г-43-107.Назначение и краткая характеристика блоков.
- •Каталитический риформинг. Назначение, сырьё , получаемые продукты , их применение. Катализаторы. Условия процесса. Варианты технологических схем.
- •Катализаторы риформинга.
- •Химия каталитического риформинга.
- •Реакции каталитического риформинга, способствующие росту октанового числа бензина.
- •Влияние фракционного и химического состава сырья на результаты каталитического риформинга.
- •Влияние каталитических ядов, содержащихся в сырье, на результаты риформинга.
- •Предварительная гидроочистка сырья риформинга. Назначение.Условия. Варианты схем.
- •Влияние давления и кратности циркуляции всг на результаты риформинга
- •Блок-схема установки риформинга для производства высокооктановых бензинов. Характеристика отдельных блоков.
- •Принципиальная схема реакторного блока установки риформинга с движущимся катализатором и непрерывной его регенерацией лф-35/11-1000. Условия процесса.
- •33. Принципиальное устройство аксиального реактора риформинга. Его недостатки.
- •Реакторы установок риформинга
- •Одноступенчатая двухстадийная.
- •Двухступенчатая.
- •Химия гидрокрекинга.
- •Технологическая схема установки одноступенчатого двухстадийного гидрокрекинга вакуумного газойля. Условия процесса
- •Варианты схем гидрокрекинга вакуумного газойля. Их блок-схемы.
- •Одноступенчатая одностадийная.
- •Одноступенчатая двухстадийная.
- •Двухступенчатая.
- •Алкилирование изобутана олефинами. Назначение,сырьё, получаемые продукты, их применение. Катализаторы. Химические основы. Условия процесса.
- •Химия сернокислотного алкилирования изобутана олефинами.
- •Технологическая схема установки сернокислотного алкилирования изобутана бутиленами. Условия процесса.
- •Принципиальное устройство и работа каскадного реактора алкилирования.
1 Основные положения теории радикально цепного механизма реакций термического распада углеводородов (Теория Райса).
Радикально-цепной механизм реакций распада углеводородов, предложенный Райсом, основан на следующих положениях:
1
. Первичный распад молекулы идет по
связи -С-С- с образованием двух радикалов:
2. Относительно устойчивыми радикалами являются Н•, СН3•, С2Н5•. Продолжительность жизни метильного и этильного радикалов составляет соответственно 0,006 и 0,002 с. Более крупные радикалы неустойчивы и подвергаются распаду. Распад крупных радикалов происходит по связи -С-С- находящейся в β-положении относительно атома углерода, имеющего неспаренный электрон:

Это обусловлено тем, что наличие свободного электрона вызывает усиление связей α за счет электронного взаимодействия его с электронами соседних углеродных атомов и ослабление связей β.
Распад крупных радикалов протекает до образования устойчивого радикала. При этом в результате распада образуется радикал с меньшим числом углеродных атомов и непредельный углеводород.
Радикалы, взаимодействуя с нейтральной молекулой, могут отрывать от нее атом водорода:

Легкость отрыва атома водорода от атома углерода в молекуле углеводорода уменьшается в ряду: третичный атом углерода > вторичный > первичный.
Скорости отрыва атома водорода от первичного, вторичного и третичного атомов углерода при 600 °С соотносятся как 1:2:10.
Радикалы могут взаимодействовать между собой с образованием нейтральной молекулы углеводорода. Новая связь С-С образуется за счет двух неспаренных электронов, имеющихся у радикалов:


2. Механизм термического крекинга нормального бутана.
Радикально-цепной
механизм. 1-я стадия:
Зарождение цепной реакции. На этой
стадии происходит распад молекул
н-бутана на радикалы:


2-я стадия: Развитие цепной реакции. На этой стадии образовавшиеся на первой стадии радикалы реагируют с новыми молекулами н-бутана:

Или


Или

3-я стадия: Распад радикалов. Образовавшиеся на 2-й стадии радикалы подвергаются распаду по β-правилу:


4-я стадия: Передача цепи. Образовавшиеся на 3-й стадии радикалы взаимодействуют с новыми молекулами н-бутана и превращаются в нейтральные молекулы (метан и этан соответственно) — конечные продукты распада исходного углеводорода наряду с С2Н4 и С3Н6, образовавшимися на 3-й стадии.
Бутильные радикалы далее подвергаются распаду(см. 3-ю стадию), и таким образом происходит цепная реакция распада.
5
стадия: Обрыв
цепной реакции. Он заключается во
взаимодействии радикалов между собой
и прекращении цепной реакции.

3. Превращение различных углеводородов при термическом крекинге.
Парафиновые углеводороды. Для парафинов характерен распад на низкомолекулярные углеводороды. Продуктами первичного paспада парафинового углеводорода являются парафин и олефин.
R 1-CH2-CH2-CH2-CH2-R2
R1-CH2-CH3
+ CH2=
СH-R2
1-CH2-CH2-CH2-CH2-R2
R1-CH2-CH3
+ CH2=
СH-R2
Распад алканов происходит преимущественно по середине цепи, так как центральные связи С-С являются наименее прочными.
Н изкомолекулярные алканы наряду с распадом подвергаются в значительной степени реакциям дегидрирования с образованием соответствующих олефинов С3Н8 С3Н6 + Н2
По мере увеличения молекулярной массы углеводорода вероятность реакций дегидрирования снижается. Так, пропан при 600 °С в равной степени превращается по двум направлениям:
С3Н8 С2Н4 + СН4 (50%) С3Н8 С3Н6 + Н2 (50%)
Нормальный бутан в тех же условиях подвергается дегидрированию уже в значительно меньшей степени:
С 4Н10 С3Н6 + СН4 (60%) С4Н10 С2Н6 + С2Н4 (30%)
С4Н10 С4Н8 + Н2 (10%)
Нафтеновые
углеводороды.
Термическая устойчивость незамещенных
нафтеновых углеводородов значительно
выше, чем парафинов. Лишь в жестких
условиях крекинга возможен распад
кольца нафтенового углеводорода

П ри
жестких условиях протекает дегидрирование
моноциклических нафтенов до соответствующих
ароматических углеводородов. Эта реакция
идет через стадию образования непредельных
углеводородов:
ри
жестких условиях протекает дегидрирование
моноциклических нафтенов до соответствующих
ароматических углеводородов. Эта реакция
идет через стадию образования непредельных
углеводородов:
Наиболее вероятным направлением крекинга алкилированных нафтеновых углеводородов является разрыв связей С-С в боковой цепи:
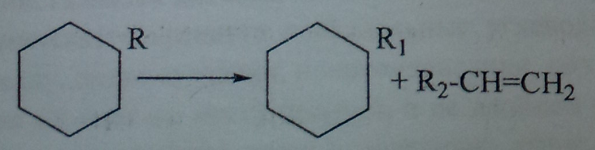
Ароматические углеводороды. Ароматические углеводороды являются наиболее устойчивыми к воздействию высоких температур. Для незамещенных ароматических углеводородов xaрактерной является реакция конденсации:

Реакция идет по радикально-цепному механизму.
Аналогично ведут себя нафталин, антрацед, фенантрен.
Алкилированные ароматические углеводороды с короткими боковыми цепями конденсируются через метильные группы. Например, при крекинге пара-ксилола поручается пара-диксилол:

Развитие реакций конденсации различных циклических углевод-ов приводит в конечном
итоге к образованию карбоидов (кокса). Ароматические углеводороды с длинными боковыми цепями подвергаются деалкилированию, при этом разрыв происходит по связи С-С между первым и вторым атомом углерода в цепи..
Непредельные углеводороды. Нефтяные фракции и остатки прямой перегонки нефти содержат очень небольшое количество непредельных углеводородов. Однако олефины являются продуктами первичного распада углеводородов. Кроме того, олефины содержатся в нефтяном сырье вторичного происхождения: в дистиллятах коксования, каталитического крекинга. В условиях термического крекинга непредельные углеводороды подвергаются распаду, полимеризации, поликонденсации, циклизации.
Распад их идет по месту простой, а не двойной связи, поскольку энергия разрыва двойной связи значительно выше, чем связи С-С. При этом наиболее вероятен разрыв простой связи, находящейся в β-положении от двойной, так как она наименее прочна:
375 259 321
R-CH2-CH2-CH2-CH=CH-CH2-R
Первичный распад олефинов протекает по радикальной цепному механизму; конечными продуктами распада молекулы непредельного углеводорода являются два олефина меньшей молекулярной массы или парафин и диеновый углеводород:
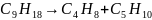
или

При невысоких температурах и повышенном давлении возможна циклизация олефинов:

При высоких температурах, характерных для пиролиза, и низком давлении олефины дегидрируются с образованием диеновых углеводородов:

Диеновые углеводороды весьма склонны к реакциям конденсации с олефинами и ароматическими углеводородами:

