
- •Розроблено:
- •2. Виконавець:
- •Лекція № 1
- •Вступ до фізичної хімії, розвиток фізичної хімії.
- •Лекція № 3
- •Рідкий стан речовини. Поверхневий натяг, в'язкість.
- •Твердий стан речовини. Кристалічний і аморфний стан.
- •Лекція № 4
- •Основи хімічної термодинаміки.
- •Перший закон термодинаміки.
- •Закон Гесса і наслідки з нього.
- •II закон термодинаміки.
- •Лекція № 5
- •Фазові рівноваги. Загальні умови. Правило фаз.
- •Загальна характеристика і властивості розчинів
- •Лекція № 6
- •Фізичні властивості розчинів, дифузія, осмос.
- •Лекція № 7
- •Закони Рауля для відносного зниження тиску над розчином
- •Розчинення в розчинах електролітів
- •Закон Рауля для підвищення температури кипіння і зниження температури замерзання
- •Хімічна рівновага. Принцип Ле – Шательє
- •Лекція № 9
- •Типи хімічних реакцій
- •Лекція № 10
- •Лекція № 11
- •Електропровідність електролітів. Питома, еквівалентна і загальна.
- •Лекція № 12
- •Електрорушійні сили. Гальванічний елемент.
- •Лекція № 13
- •Дифузійний потенціал.
- •Потенціометричні визначення концентрації водневих розчинів.
- •Для виділення 1 кг речовини, потрібно пропустити через електроліт одну й ту ж кількість електрики, її позначають буквою f і називають числом Фарадея.
- •Лекція № 14
- •Колоїдна хімія. Вступ, загальна характеристика, класифікація.
- •Лекція № 15
- •Поверхневі явища. Сорбційні процеси, їх класифікація, адсорбція на межі різноманітних фаз.
- •Адсорбція тверде тіло –газ.
- •Лекція № 16
- •Адсорбція на межі тверде тіло – розчин.
- •Адсорбція на межі розчин – розчин.
- •Лекція № 17
- •Адсорбція електролітів
- •Адсорбція на межі розчин – газ.
- •Лекція № 18
- •Отримання колоїдних систем різними методами. Особливі властивості колоїдних систем по відношенню до істинних розчинів.
- •Методи очищення дисперсних систем.
- •Електролітичні властивості. Дослід Рейса. Електрофорез та електроосмос, їх практичне застосування.
- •Лекція № 19
- •Молекулярне - кінетичні властивості колоїдних систем
- •Лекція № 20
- •Оптичні властивості колоїдних розчинів. Ефект Тиндаля.
- •Лекція № 21
- •Будова міцели гідрозолю. Будова подвійного електричного шару.
- •Будова міцели золю.
- •Лекція № 22
- •Коагуляція гідрофобних золей електролітами. Поріг коагуляції. Практичне застосування коагуляції
- •Лекція № 23
- •Колоїдні поверхнево - активні речовини.
- •Вільнодисперсні системи, їх в'язкість. Зв'язанодисперсні системи, гелеутворення та пептизація.
- •Лекція № 24
- •Загальна характеристика суспензій. Агрегативна стійкість, коагуляція суспензій. Методи отримання.
- •Грубодисперсні (мікрогетерогенні) системи – емульсії.
- •Лекція № 25
- •Лекція № 26
- •Лекція № 27
- •Високомолекулярні сполуки вмс
- •Лекція № 28
- •Набухання в технології харчових виробництв.
- •Перелік літератури
Хімічна рівновага. Принцип Ле – Шательє
Необоротні реакції після завершення реакції не можуть утворювати вихідні речовини Zn + 2HNO3 Zn (NO3)2 + H2. Більшість відомих реакцій є оборотними.
N2 + 3H2 2NH3
На початку швидкість прямої реакції (V1) велика, a V2 = 0, з часом V1 зміщується, a V2 збільшується. Коли V1 = V2 ( при t = const) наступає хімічна рівновага.
V1 = k1 [N2] [H2]3
V2 = k2 [NH3]2
При рівновазі:
V1 = V2
k1 [N2] [H2]3 = k2 [NH3]2
![]()
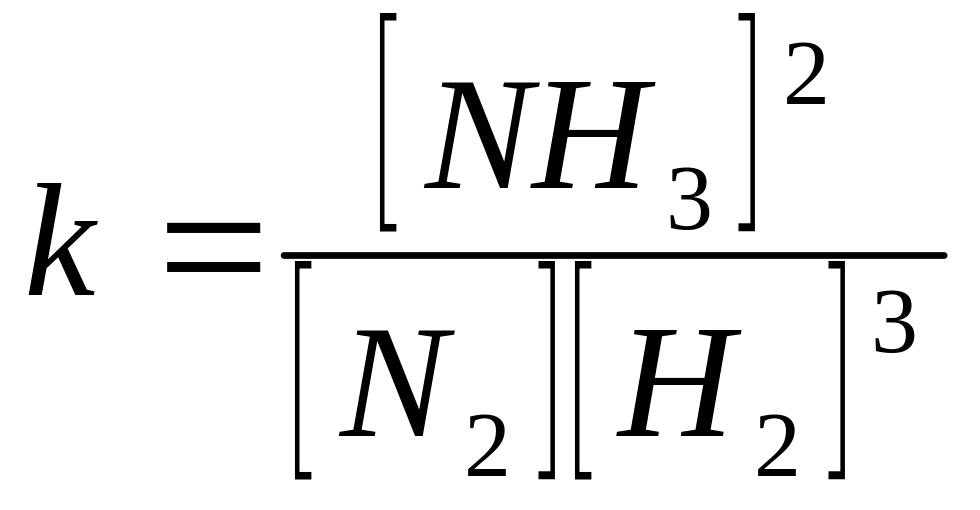 -
константа
хімічної рівноваги
-
константа
хімічної рівноваги
mA + nB = pС + qD
![]() -
математичний вираз закону діючих мас.
-
математичний вираз закону діючих мас.
Хімічна рівновага в оборотних реакціях при Т=const встановлюється тоді, коли відношення добутку концентрацій речовин що вступили в реакцію, дорівнює концентрації речовин, утворених в результаті хімічної реакції.
Направлення зміщення рівноваги в загальному вигляді визначається
принципом Ле - Шатальє. Якщо змінити одну з умов, при яких система знаходиться в рівновазі, то рівновага буде змінюватися у напрямку реакцій, протилежних зовнішніх дій.
Вплив концентрації реагуючих речовин, температури та тиску
Збільшення концентрації реагуючих вихідних речовин зміщує рівновагу вправо, продукт реакції зміщує рівновагу вліво. Підвищення температури приводить до взаємодії частинок, які мають підвищену енергію. Ця енергія називається енергією активації. Зовнішніми джерелами активації можуть бути теплота, світлове опромінення, електрична енергія.
Залежність const швидкості ( k ) хімічної реакції від температури виражається рівнянням Арреніуса:
![]()
де, kо - предекспоненціальний множувач ko = zp
z - число ударів за секунду
р - стеричний фактор, який виражає ступінь найбільш вигідної орієнтації частинок при ударах
l- основа натурального логарифма
Е - енергія активації
R - універсальна газова const
Т - абсолютна температура
![]()
Тиск впливає на хімічну рівновагу тільки для тих хімічних реакцій в яких є гази, підвищення тиску буде змінювати хімічну рівновагу в напрямку менших об’ємів.
Лекція № 9
Тема: Кінетична класифікація хімічних реакцій, реакції першого та другого порядку, енергія активації.
Мета: Вивчити класифікацію хімічних реакцій: молекулярні реакції, сполучені, ланцюгові та каталітичні.
Типи хімічних реакцій
Молекулярність та порядок реакції
Молекулярність визначається mіn числом молекул.
Мономолекулярні І2 І +І; N2O5 2NO2 + 1/2O2
Одна молекула А В + С ... V = kC
Біомолекулярні Н2 + І2 = 2НІ ∙ СН3СООН + C2H5OH CH3COO C2H5 + Н2О
2 молекули А + В АВ V = kC1C2
Тримолекулярні 4NO + O2 + 3H2 NO2 + N2O + 3H2O
3 молекули А + В + С = Д + Е + FV = kC1C2C3
Порядок реакції визначають сумою показників ступенів концентрацій у математичному виразі закону діючих мас.
Дуже рідко зустрічаються тримолекулярні реакції, а більш високого порядку взагалі не відомі. Вони протікають через ряд стадій. Якщо швидкості окремих стадій реакції різні, то загальна швидкість визначається самою повільною лімітуючою реакцією.
Порядок реакції дорівнює сумі ступенів концентрації в кінетичному рівнянні. Реакції, що протікають в декілька стадій, та швидкість визначається найбільш повільною елементарною стадією.
Сполучені реакції - чи індуцировані реакції. Деякі хімічні взаємодії не протікають за сумарним рівнянням, а проходять через ряд проміжних процесів.
HBrO3 + 3H2SO3 = 3H2SO4 + HBr
HBrO3 + H2SO3 = H2SO4 + HBrO2
HBrO2 + H2SO3 = H2SO4 + HBrO
HBrO + H2SO3 = H2SO4 + HBr
HBrO4 - актор
H2SO3 - індуктор
в окислювальне - відновних процесах
Ланцюгові реакції: протікають через ряд зв'язаних між собою елементарних процесів. Кожний такий процес викликається активною часткою (збуджена молекула, вільний атом, радикал, позитивний чи негативний - іон.) Довжина ланцюга вимірюється числом ланок.
Швидкість реакції збільшується, може привести до вибуху, горіння:
СІ2 + nV = СІ. + СІ.
СІ. + Н2 = НСІ + Н.
Н. + СІ2 = КСІ + СІ.
СІ. + СІ. = СІ2
Н. + Н. = Н2
Каталітична реакція
Каталізатором називається речовина, яка прискорює реакцію, беручи участь в елементарній стадії, але виходить з такої взаємодії хімічно незмінною.
Радикальні реакції перебігають через проміжне утворення вільних радикалів та атомів. Вільними радикалами є частинки, які характеризуються наявністю неспарених електронів. Вільними радикалами можуть бути вільні атоми (Н, СІ∙), а також молекули NO, NO2.
Фотохімічні реакції – хімічні реакції, зумовлені поглинанням реагуючими речовинами світлової енергії. Фотохімічною реакцією є реакція утворення озону з кисню. Також прикладом фотохімічної реакції є реакція синтезу хлороводню з водню та хлору; синтез рослинами складних органічних речовин в процесі їх життєдіяльності (фотосинтез).
