
- •9. 9.Основы молекулярно-кинетической теории.
- •Идеальный газ. Термодинамические параметры. Уравнение состояния. Основное уравнение мкт.
- •9. Классическая статистика.
- •Классическая статистика. Функция распределения Максвелла. Барометрическая формула. Распределение Больцмана.
- •Теплоемкость вещества.
- •II закон термодинамики. Тепловые двигатели.
- •1) По Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу;
- •2) По Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
- •Диффузия, теплопроводность и внутреннее трение.
- •14. Реальные газы и жидкости .
- •1. Учет собственного объема молекул.
- •2. Учет притяжения молекул.
- •15. Динамика жидкостей и газов .
- •1. Кристаллографический признак кристаллов.
- •2. Физический признак кристаллов.
- •Теплоемкость твердых тел
- •Фазовые переходы I и п рода
- •Диаграмма состояния. Тройная точка
14. Реальные газы и жидкости .
Изотермы реального газа. Уравнение Ван-дер-Ваальса. Поверхностное натяжение. Давление Лапласа. Капиллярные явления. Осмос.
Для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравнение Клапейрона—Менделеева.
![]() (для
моля газа), описывающее идеальный
газ, для реальных газов непригодны.
(для
моля газа), описывающее идеальный
газ, для реальных газов непригодны.
1. Учет собственного объема молекул.
не
![]() ,
a
,
a
![]() ,
где
b
—
объем, занимаемый самими молекулами.
Объем b
равен
учетверенному собственному объему
молекул.
,
где
b
—
объем, занимаемый самими молекулами.
Объем b
равен
учетверенному собственному объему
молекул.
2. Учет притяжения молекул.
Приводит к появлению дополнительного давления на газ, называемого внутренним давлением.
![]() Вводя
эти поправки, получим уравнение
Ван-дер-Ваальса для
моля газа (уравнение
состояния реальных газов):
Вводя
эти поправки, получим уравнение
Ван-дер-Ваальса для
моля газа (уравнение
состояния реальных газов):
![]() где
поправки а и b
— постоянные
для каждого газа величины, определяемые
опытным путем (записываются уравнения
Ван-дер-Ваальса для двух известных из
опыта состояний газа и решаются
относительно а
и
b).
где
поправки а и b
— постоянные
для каждого газа величины, определяемые
опытным путем (записываются уравнения
Ван-дер-Ваальса для двух известных из
опыта состояний газа и решаются
относительно а
и
b).
Изотермы Ван-дер-Ваальса и их анализ
Для
исследования поведения реального газа
рассмотрим изотермы
Ван-дер-Ваальса —
кривые зависимости р
от
Vm
при
заданных Т,
определяемые
уравнением Ван-дер-Ваальса для моля
газа.


![]()
Для
нахождения критических параметров
напишем
![]() (1)
(1)
Поскольку в критической точке все три корня совпадают и равны Vк, уравнение приводится к виду
![]()
Или
![]() (2)
(2)
Так как уравнения (1) и (2) тождественны, то в них должны быть равны и коэффициенты при неизвестных соответствующих степеней. Поэтому можно записать
![]()
![]()
![]() Решая
полученные уравнения, найдем:
Решая
полученные уравнения, найдем:
![]()
![]()
![]()
Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая (рис. 91), ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят
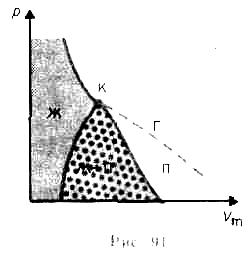
Сравнивая изотерму Ван-дер-Ваальса с изотермой Эндрюса (верхняя кривая на рис. 92), видим, что последняя имеет прямолинейный участок 2—6, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван-дер-ваальсовой изотермы 5—6 и 2—3. Эти неустойчивые состояния называются метастабильными. Участок 2—3 изображает перегретую жидкость, 5—6 — пересыщенный пар. Обе фазы ограниченно устойчивы
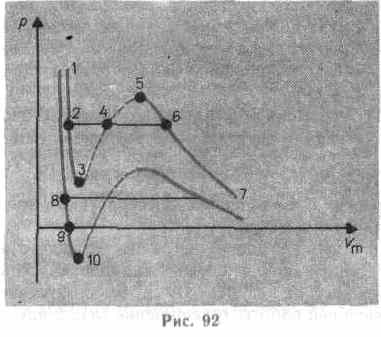
Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8—9 на нижней изотерме соответствует перегретой жидкости, участок 9— 10 — растянутой жидкости.
Поверхностное натяжение
Поверхностное натяжение а равно силе поверхностного натяжения, приходящейся на единицу длины контура, ограничивающего поверхность. Единица поверхностного натяжения — ньютон на метр (Н/м) или джоуль на квадратный метр (Дж/м2) Большинство жидкостей при температуре 300 К имеет поверхностное натяжение порядка 10-2—10-1 Н/м. Поверхностное натяжение с повышением температуры уменьшается, так как увеличиваются средние расстояния между молекулами жидкости.
Из практики известно, что капля воды растекается на стекле и принимает форму, изображенную на рис. 98, в то время как ртуть на той же поверхности превращается в несколько сплюснутую каплю (рис. 99). В первом случае говорят, что жидкость смачивает твердую поверхность, во втором — не смачивает ее. Смачивание зависит от характера сил, действующих между молекулами поверхностных слоев соприкасающихся сред.
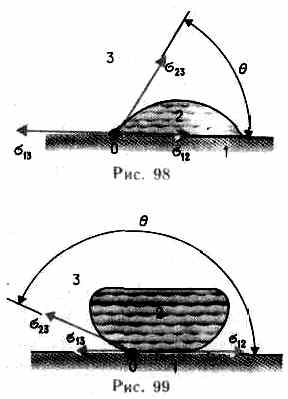
Полное смачивание (в данном случае =0). Если 12>13+23, то жидкость стягивается в шаровую каплю, в пределе имея с ней лишь одну точку соприкосновения (например, капля воды на поверхности парафина),— имеет место полное несмачивание (в данном случае =).
.
Давление под искривленной поверхностью жидкости
На каждый бесконечно малый элемент длины l этого контура действует сила поверхностного натяжения F=l, касательная к поверхности сферы. Разложив F на два компонента (F1 и F2), видим, что геометрическая сумма сил F2 равна нулю. Поэтому равнодействующая сил поверхностного натяжения, действующих на вырезанный сегмент, направлена перпендикулярно плоскости сечения внутрь жидко-

сти и равна алгебраической сумме составляющих F1:

Разделив
эту силу на площадь основания сегмента
r2,
вычислим избыточное (добавочное)
давление на жидкость:
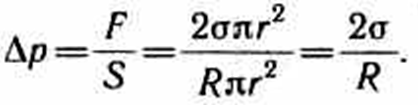
Формула Лапласа,
Капиллярные явления
Если поместить узкую трубку (капилляр) одним концом в жидкость, налитую в широкий сосуд, то вследствие смачивания или несмачивания жидкостью стенок капилляра кривизна поверхности жидкости в капилляре становится значительной.
![]()
где — плотность жидкости, g — ускорение свободного падения.
Если
m
— радиус
капилляра,
— краевой угол, то из рис. 101 следует,
что
![]() ,
откуда
,
откуда
![]() В
соответствии с тем, что смачивающая
жидкость по капилляру поднимается, а
несмачивающая — опускается,
В
соответствии с тем, что смачивающая
жидкость по капилляру поднимается, а
несмачивающая — опускается,

В
тонких капиллярах жидкость поднимается
достаточно высоко. Так,
при полном смачивании (![]() = 0) вода (=1000
кг/м3,
=0,073
Н/м) в капилляре диаметром 10 мкм поднимается
на высоту h3
м.
= 0) вода (=1000
кг/м3,
=0,073
Н/м) в капилляре диаметром 10 мкм поднимается
на высоту h3
м.
Капиллярные явления играют большую роль в природе и технике. Например, влагообмен в почве и в растениях осуществляется за счет поднятия воды по тончайшим капиллярам. На капиллярности основано действие фитилей, впитывание влаги бетоном и т. д.
