
- •9. 9.Основы молекулярно-кинетической теории.
- •Идеальный газ. Термодинамические параметры. Уравнение состояния. Основное уравнение мкт.
- •9. Классическая статистика.
- •Классическая статистика. Функция распределения Максвелла. Барометрическая формула. Распределение Больцмана.
- •Теплоемкость вещества.
- •II закон термодинамики. Тепловые двигатели.
- •1) По Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу;
- •2) По Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
- •Диффузия, теплопроводность и внутреннее трение.
- •14. Реальные газы и жидкости .
- •1. Учет собственного объема молекул.
- •2. Учет притяжения молекул.
- •15. Динамика жидкостей и газов .
- •1. Кристаллографический признак кристаллов.
- •2. Физический признак кристаллов.
- •Теплоемкость твердых тел
- •Фазовые переходы I и п рода
- •Диаграмма состояния. Тройная точка
9. 9.Основы молекулярно-кинетической теории.
Основные положения молекулярно-кинетической теории. Идеальный газ. Термодинамические параметры. Равновесные и неравновесные процессы. Уравнение состояния. Основное уравнение молекулярно-кинетической теории идеального газа.
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным (например, кислород и гелий), а также при низких давления» и высоких температурах близки по своим свойствам к идеальному газу. Кроме того, внеся поправки, учитывающие собственный объем молекул газа и действующие молекулярные силы, можно перейти к теории реальных газов.
Идеальный газ. Термодинамические параметры. Уравнение состояния. Основное уравнение мкт.
Вывод основного уравнения молекулярно-кинетической теории (МКТ) идеального газа.
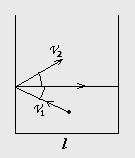 Рассмотрим
сосуд кубической формы с размером l:
Рассмотрим
сосуд кубической формы с размером l:
Пусть в этом объеме движется только один атом и сталкивается об стенку сосуда со скоростью V1 и отражается V2 .
Определим силу удара об стенку сосуда (по II закону Ньютона):
 f
·t
= m
·V
f
·t
= m
·V
![]()
V = 2V; V = V2 – V1
![]() ;
;
![]() – сила
удара одной молекулы об стенку сосуда
– сила
удара одной молекулы об стенку сосуда
Вычислим силу удара об стенку сосуда N – молекул:

![]() – средняя квадратичная скорость.
– средняя квадратичная скорость.
![]()
![]()
![]()
![]()
![]()
9. Классическая статистика.
Закон равномерного распределения энергии по степеням свободы. Длина свободного пробега и эффективный диаметр молекул. Распределение Максвелла. Барометрическая формула. Распределение Больцмана.
Классическая статистика. Функция распределения Максвелла. Барометрическая формула. Распределение Больцмана.
Закон равномерного распределения энергии по степеням свободы молекул.
В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы

где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы:

Внутренняя энергия для произвольной массы т газа.

где М — молярная масса, — количество вещества.
Средняя длина свободного пробега молекул и эффективный диаметр молекулы.

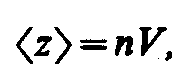


 Классическое
распределение по скоростям (Максвелла):
Классическое
распределение по скоростям (Максвелла):
Справедливо для всех частиц:
![]()
dN – число частиц, попадающих в определенный интервал скоростей.
N – число всех частиц.
f(V) – функция распределения по скоростям
dV – элементарный объем скоростей.
Рассмотрим функцию распределения по скоростям в сферической системе координат:
![]()
![]()
![]() -
функция распределения Максвелла.
-
функция распределения Максвелла.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Величина А (амплитуда вероятности) находится из условия нормировки:
![]() -
условие нормировки
-
условие нормировки
![]() ;
;
![]()
Аналогично находим (vy) и (vz):
![]()
![]()
тогда
![]()

Барометрическая формула. Распределение Больцмана.




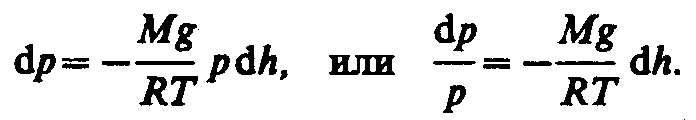

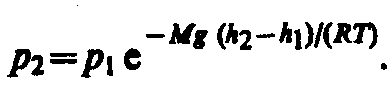
![]()
![]()
11 Первое закон термодинамики.
Внутренняя энергия системы. Теплоемкость вещества. Первый закон термодинамики. Применение первого закона термодинамики к изопроцессам в идеальном газе. Адиабатический процесс.
![]()
Внутренняя
энергия газа
![]()
