
- •1Предмет фізики. Матеріали та сировина. Поле та речовина. Основна властивість матерії.
- •2 Методи наукового пізнання. Роль фізики у розвитку техніки. Методи дослідження сировини та матеріалів.
- •3 Основні поняття кінематики матеріальної точи. Види руху. Матеріальна точка, система відліку. Шлях переміщення
- •5 Миттєве прискорення. Прискорення при поступальному русі
- •6 Формула прискорення при криволінійному русі матеріальної точки. Нормальне і тангенційне прискорення.
- •7 Кінематика обертального руху. Кутова швидкість та кутове прискорення. Зв'язок лінійних та кутових величин.
- •8 Інерціальна система відліку. Перший закон Ньютона Перший закон Ньютона. Інерціальна система відліку
- •Другий закон Ньютона: базовий закон динаміки
- •12 Третій закон Нютона. Центр мас механічної системи. Швидкість центра мас. Третій закон Ньютона: закон дії та протидії
- •13 Закон збереження імпульсу замкненої механічної системи. (вивід)
- •14Момент сили. Момент імпульсу. Одиниці вимірювання
- •15Основний закон динаміки обертального руху. Закон збереження моменту імпульсу
- •16 Механічна робота та енергія
- •17 Кінетична енергія та робота. Пружність
- •18Консервативні сили . Потенціальне поле. Потенціальна енергія.
- •19 Повна механічна енергія. Закон збереження механічної енергії Закон збереження механічної енергії
- •20 Закони зіткнення тіл. (абсолютно пружний і абсолютно непружний)
- •21 Момнт імпульсу та моменти інерції твердого тіла
- •22 Розрахунок моменту інерції суцільного циліндра
- •24 Пара сил. Момент пари. Умови рівноваги твердого тіла.
- •25 Основні види деформації. Сили пружності. Поняття механічного напруження.
- •26 Деформація стиску-розтягу. Закон гука. Модуль юнга, коефіцієнт пуасона
- •27 Деформація зсуву. Кут зсуву, модуль зсуву. Закон гука
- •Закон Гука для зсуву
- •28 Пружні властивості реальних твердих тіл. Діаграма розтягу
- •Сила тертя кочення
- •Закон Амонтона — Кулона
- •32Основні закони гідро- та аеростатики(закон Паская, закон сполучених посудин, закон Архімеда)
- •33 Метод гідростатичного зважування
- •34 Основі гідро-та аеродинаміки. Рівняння нерозривності.
- •37Рух тіл у рідинах і газах. Лобовий опір, підіймальна сила. Формула Стокса
- •38 Ламінарний та турбулентний рух. Число Рейнольдса
- •39 Методи вимірювання в’язкості. Метод падаючої кульки. Віскозиметрія
- •2 Основне рівняння молекулярно кінетичної теорії
- •3 Три положення молекулярно-кінетичної теорії
- •5 Барометрична формула. Розподіл Максвела-Больцмана
- •6 Внутрішня енергія термодинамічної системи. Робота. Теплота.
- •7 Перший початок термодинаміки
- •Теплоємність. Рівняння Майєра
- •Закон рівномірного розподілу енергії за ступенями вільності. Коефіцієнт Пуассона.
- •10Класична теорія теплоємності. Закон Дюлонга і Пті
- •11Квантова теорія теплоємності дебая
- •12 Другий початок термодинаміки
- •14 Адіабатичний процес Рівняння адіабати
- •15 Фазові переходи першого і другогороду. Правило гібса. Діаграми стану.
- •[Ред.]Класифікація
- •[Ред.]Приклади
- •[Ред.]Діаграми Хареля
- •16 Зміна агрегатного стану оечовини. Процеи випаровування, конденсації плавлення, кристалізації
- •17 Абсолютна та відносна вологість вологість повітря
- •18 Прилади і датчики вимірювання вологості
- •19 Побутове та промислове кондиціонування повітря
- •20 Пароізоляція. Сушильні камери.
2 Основне рівняння молекулярно кінетичної теорії
Молекулярно-кінетична теорія виходить із того, що речовина, зокрема газ складається з великої кількості мікроскопічних частинок (молекул), які рухаються хаотично. Частинки стикаються між собою та зі стінками посудини, створюючи на ці стінки тиск. Усі зіткнення вважаються пружними, тобто проходять без втрати енергії. Середня кінетична енергія руху частинок залежить від температури.
Середня кінетична енергія руху молекули
![]() ,
,
де
m — маса частинки,
v — її швидкість, ![]() —
стала Больцмана, T — температура.
—
стала Больцмана, T — температура.
Середня швидкість частинок у газі дорівнює
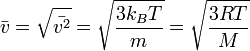 ,
,
де
R — газова
стала, ![]() — молярна
маса.
— молярна
маса.
Тиск
газу на стінки посудини визначається
з того міркування, що при пружньому
відбитті частинки від стінки, зміна
її імпульсу дорівнює ![]() ,
де
,
де ![]() —
перпендикулярна до стінки складова
швидкості. Підрахувавши переданий за
час
імпульс,
і прирівнявши його до імпульсу
сили для
тиску отримуємо
—
перпендикулярна до стінки складова
швидкості. Підрахувавши переданий за
час
імпульс,
і прирівнявши його до імпульсу
сили для
тиску отримуємо
![]() ,
,
де n — кількість частинок в одиничному об'ємі.
3 Три положення молекулярно-кінетичної теорії
Основні положення МКТ речовини:
I. Будь-які речовини мають дискретну (переривчасту) будову. Вони складаються з найдрібніших частинок молекул і атомів. Підтвердженням дискретності є прокатка, кування металу, отримання 1974 року фотографії окремих молекул і атомів, розчинність речовин тощо.
Молекули — найменші частинки, які мають хімічні властивості речовини. Молекули складаються з простіших частинок — атомів хімічних елементів. У природі є 92 хімічні елементи. Разом із штучними наразі налічується 105 елементів.
Речовину, яка побудована з атомів лише одного виду, називають елементом (водень, кисень, азот тощо). Кожен елемент має свій номер Z в таблиці Менделєєва. Число Z визначає кількість протонів у ядрах атомів і електронів, що рухаються в атомі навколо ядра.
II. Молекули знаходяться в стані неперервного хаотичного (невпорядкованого) руху, що називається тепловим і у загальному випадку є сукупністю поступального, обертального і коливального рухів.
Під час нагрівання речовини швидкість теплового руху і кінетична енергія його частинок збільшуються, а під час охолодження зменшуються. Ступінь нагрітості тіла характеризує його температура, яка є мірою середньої кінетичної енергії хаотичного поступального руху молекул цього тіла.
III. Молекули взаємодіють одна з одною із силами електромагнітної природи, причому на великих відстанях вони притягуються, а на малих — відштовхуються. Сили притягання і відштовхування між молекулами діють постійно.
Молекули різних речовин по-різному взаємодіють одна з одною. Ця взаємодія залежить від типу молекул і відстані між ними. Залежно від характеру руху і взаємодії молекул розрізняють три стани речовини: твердий, рідкий, газоподібний (плазма).
4 Закон розподілу молекул за швидкостями. Розподіл Максвела. Середнята середньоквадратична швидкості.
мовірність з точки зору математики є числова характеристика можливості здійснення якої-небудь випадкової події при тих чи інших умовах, яка може неодноразово повторюватися. Так, наприклад, рівномірний розподіл молекул по об’єму викликаний хаотичним рухом молекул. Основною задачею теорії ймовірності є вияснення закономірностей, які виникають при взаємодії великої кількості випадкових факторів (закон радіоактивного розпаду атомів, поняття температури тіла тощо).
Самовільне відхилення фізичних величин від їх середніх значень, зумовлене якими-небудь причинами, називають флуктуаціями. Наприклад, значення температури, швидкості руху молекул, довжина вільного пробігу тощо, – всі вони зумовлені відхиленням від середніх значень параметрів, викликаних хаотичним рухом молекул та їхніми зіткненнями.
Розглянемо інший розподіл молекул, а саме їхній просторовий розподіл у полі зовнішніх сил. Хорошою моделлю може бути повітря в полі притягання Землі. Дістанемо такий розподіл для тиску газу та концентрації молекул, припустившись таких спрощень:
розглядається ідеальний газ;
температура ![]() газу
є скрізь однаковою;
газу
є скрізь однаковою;
поле сил є однорідним;
маса всіх молекул є однаковою.
Внаслідок безперервного хаотичного руху молекул, а також взаємного зіткнення молекул під час цього руху кожна молекула зокрема може змінювати свою швидкість як за величиною, так і за напрямком. Тому в газі будуть як швидкі, так і повільні молекули. Але, хоча швидкості окремих молекул змінюються, властивості газу у стані термодинамічної рівноваги загалом при цьому не змінюються: залишаються постійними параметри системи. Зумовлено це тим, що швидкості газових молекул підлягають певному законові, тобто, незважаючи на повну хаотичність молекулярних рухів, розподіл молекул за швидкостями виявляється не випадковим, а цілком визначеним. До того ж він є однозначним і єдино можливим.
Дж. Максвелл теоретично розв’язав задачу про розподіл молекул ідеального газу за швидкостями поступального руху. Він встановив закон, що дає змогу визначити, яка кількість молекул із загальної кількості молекул ідеального газу в одиниці об’єму мають при даній температурі швидкості, які лежать в інтервалі від до . Дж. Максвелл вважав, що газ складається з великої кількості однакових молекул, температура в усіх частинах посудини з газом теж однакова і відсутні зовнішні дії на газ.
![]() середньоквадратична
швидкість молекул.
середньоквадратична
швидкість молекул.
![]() -
Закон Максвелла для розподілу молекул
ідеального газу по швидкостях.
-
Закон Максвелла для розподілу молекул
ідеального газу по швидкостях.
