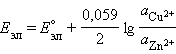- •Экзаменационный билет № 16
- •Отличительные черты катализаторов:
- •Химические источники тока
- •Экзаменационный билет № 17
- •Энтальпия
- •Второй закон Фарадея
- •Экзаменационный билет № 19
- •Химическая термодинамика
- •Свойства системы
- •Коррозия (по механизму)
- •Экзаменационный билет № 20
- •Устойчивость коллоидных систем.

Оглавление:
Билет №16
Билет №17
Билет №18
Билет №19
Билет №20
Экзаменационный билет № 16
Понятие о катализе. Отличительные черты катализаторов, механизм их действия. Примеры промышленных катализаторов.
Химические источники тока. Первичные гальванические элементы, аккумуляторы, топливные элементы.
Ответ:
Катализом называется явление изменения скорости реакции под воздействием небольших добавок специфических веществ, количество которых в ходе реакции не изменяется.В каталитических процессах скорость основной реакции может и увеличиваться, и уменьшаться. Вещества, ускоряющие реакцию, называются катализаторами, а замедляющие - ингибиторами.
Катализ принято подразделять на следующие типы:
1. гомогенный (реагенты и катализатор в (ж) и (г)).
2. гетерогенный (реагенты (ж) или (г), а катализатор (тв)).
3. ферментативный (К-сложные белковые образования - ферменты; он бывает гомогенный и гетерогенный, но из-за специфических особенностей действия ферментов его выделяют в самостоятельный тип катализа).
Отличительные черты катализаторов:
Вводится в систему в очень небольших количествах по сравнению с массой реагентов.
Имеет очень высокую эффективность. Например, одна частица мелкодисперсной платины (платиновая чернь) в одну секунду разлагает 105 молекул Н2О2.
По окончании реакции катализатор остается в химически неизменном состоянии и не расходуется, т.е. его участие в реакции не отражается общим стехиометрическим уравнением. Однако физически катализатор изменяется. Например, кристаллический MnO2 в процессе каталитического разложения хлората калия KClO3 превращается в мелкодисперсный порошок. Эти изменения свидетельствуют о том, что в ходе реакции на определенных стадиях катализатор вступает во взаимодействие с реагентами, а по окончании ее вновь выделяется.
Катализатор одинаково ускоряет как прямую, так и обратную реакцию, т.е. не смещает равновесие и не влияет на его константу, а лишь уменьшает время достижения равновесного состояния.
Действие катализатора сводится к понижению Еа при образовании промежуточных нестойких соединений, которые в дальнейшем распадаются на продукты реакции с выделением катализатора в химически неизменном виде. Следует отметить одну важную особенность катализаторов. Они не влияют на термодинамику реакций, т.е. не изменяют энтальпию и энергию Гиббса реакции. Если G>0, то в присутствии катализаторов она не станет самопроизвольной.
Как правило катализаторы обладают специфичностью (селективностью), т.е. способностью изменять скорость и (или) направление только конкретной химической реакции или группы однородных реакций. Это позволяет из одних и тех же исходных веществ в зависимости от вида катализатора получать разные продукты.
К наиболее распространенным промышленным катализаторам относятся: Pt, Rh, Pd, Fe, Ni, CuO, RuO2, V2O5, NiO, Fe2O3, ZnO, SiO2, Cr2O3, Al2O3, Ag2O, алюмосиликаты.
механизм:
О3+NO=NO2+O2
NO2+O=NO+O2
О3+O=2O2
А2В+К = К…А2…В = АК+АВ
АК+В = В…А…К=К+АВ
А2В+В=2АВ
Химические источники тока
Каждый гальванический элемент состоит из двух электродов (окислительно-восстановительных пар), один из которых является поставщиком электронов (анод), а другой их принимает (катод). В гальванических элементах источником электрического тока является химическая реакция. Любая химическая реакция термодинамически разрешена, если ΔG < 0. Из соотношений ΔG = –nFE и ΔG° = –nFE°следует, что электрохимическая реакция, а в общем случае любая окислительно-восстановительная реакция может протекать самопроизвольно, если E > 0 или для стандартных условий E° > 0.
ЭДС гальванического элемента равна разности электродных потенциалов составляющих его электродов. В соответствии с принятой формой записи гальванического элемента его ЭДС равна электродному потенциалу правого электрода (окислителя) минус электродный потенциал левого электрода (восстановителя).
![]()
|
|
|
|
|
|
Пользуясь этими соотношениями и таблицей стандартных электродных потенциалов, можно предсказать возможность осуществления многих окислительно-восстановительных реакций.
В случае элемента Даниэля–Якоби (–)Zn¦Zn2+||Cu2+¦Cu(+)
![]()
|
|
|
Для нестандартных условий ЭДС элемента Даниеля–Якоби находится из разности электродных потенциалов, вычисленных по уравнению Нернста:
|
|
|
![]()
![]()