
Выберите правильный ответ:
4. Ряд, в котором представлены только кислые соли _______________________
1) KHCO3; CaSO4; K[Al(OH)4];
2) NaH2PO4; KHS; Mn(HCO3)2;
3) KHS; НClO4; Ca(OH)2;
4) KНCO3; K2[Zn(OH)4]; MnCl2.
5. Число щелочей среди перечисленных веществ: K2O2; NH4OH; Mg(OH)2; KClO; Ba(OH)2; Mn(OH)2; NaOH; CaCO3 равно:
1) 3; 2) 4; 3) 5; 4) 8.
6. К амфотерным оксидам относятся _________________________________
1) MgO; ВaO; 2) SO3; СO2;
3) Al2O3; ВеO; 4) PbO; ZnO.
7. Оксид серы (VΙ) проявляет только _________________________________
1) основные свойства; 3) амфотерные свойства;
2) кислотные свойства; 4) свойства безразличного оксида.
8. Установите соответствие между формулой вещества и его принадлежностью
к определенному классу неорганических соединений:
Название |
Класс |
А) K[Al(OH)4] |
1) двойная соль |
Б) MgNH4PO4 |
2) основная соль |
В) (CuOH)2CO3 |
3) средняя соль |
Г) KH2PO4 |
4) кислая соль |
|
5) комплексная соль |
|
6) смешанная соль |
9. Хлорид железа (ΙΙΙ) получают реакцией _________________________________
1) Fe + Cl2 2) Fe + HCl 3) Fe2O3 + H2O
4) FeO + HCl 5) Fe2O3 + KOH 6) Fe2O3 + HCl
10. Конечным веществом в цепочке превращений на основе азота:
HNO3 (конц.)
 Х1
Х1
 Х2
Х2
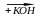 Х3
является _____________
Х3
является _____________
1) нитрит калия; 2) оксид азота (Ι);
3) оксид азота (ΙV); 4) гидроксид аммония.
Составьте уравнения протекающих реакций.
11.Составьте электронную формулу атомов бария, графически укажите валентные электроны в нормальном и возбужденном состояниях. Какие степени окисления может проявлять атом бария? Приведите примеры оксида и гидроксида бария в соответствующих степенях окисления, укажите их характер.
12. Реакция восстановления оксида меди (II) алюминием возможна
G0 обр. 3CuO + 2Al = Al2O3 + 3Cu
кДж/моль -129,8 -1582
свободная энергия Гиббса ( G х.р.) равна:
-1192 кДж;
-3576 кДж;
+1192 кДж;
4) +3576 кДж .
13. Оптимальные условия синтеза оксида серы (VI)
2SO2 + O2 2SO3 (- Hx.p.):
P
 ,
to
3)
P
,
to
3)
P ,
to
,
to
P , to 4) P , to
1 4. Краткое ионное уравнение имеет вид: 2H+ + CO2-3 CO2 + H2O при взаимодействии:
( NH4)2CO3 + HBr
L i2CO3 + H2SiO3
C aCO3 + H2SO4
B aCO3 + HCl
15. При электролизе раствора хлорида натрия среда раствора у катода:
кислая
нейтральная
щелочная
16. Расположите гидроксиды в порядке увеличения их основных свойств: CsOH, KOH, Fe(OH)3, Ca(OH)2, Fe(OH)2
17. Покажите распределение валентных электронов по орбиталям для каждого атома в молекуле Br2 ; определите механизм образования связи и ее вид; укажите, имеет ли место гибридизация, ее тип; покажите геометрическую структуру молекул.
18. Упарили вдвое (по объему) 2 л 10%-го раствора хлорида натрия (плотность 1,07 г/мл). Определите молярную концентрацию полученного раствора.
19. Подберите коэффициенты в оскислительно
– восстановительных реакциях, укажите
окислитель и восстановитель
