
- •1. Предмет фтт. Основные проблемы фтт.
- •2. Классификация твердых тел. Типы связи.
- •4. Молекулярные кристаллы(мк). Ионные кристаллы(ик).
- •6. Ковалентные кристаллы (кк). Металлы. Плотнейшие упаковки.
- •7. Кристаллические решетки. Вектор трансляции. Элементарная ячейка. Примитивная ячейка Вигнера-Зейтца.
- •8. Решетки Браве. Сингонии. Индексы Миллера.
- •9. Элементы симметрии кристаллов. Точечная группа симметрии. Пространственные группы симметрии.
- •10. Дифракция в кристаллах. Закон Вульфа-Брэгга. Основные дифракционные методы.
- •11. Обратная решетка: свойства, физический смысл.
- •12. Зоны Бриллюэна.
- •13. Классификация дефектов кристаллического строения.
- •14. Точечные дефекты: основные типы, равновесная концентрация, дефекты Шоттки и Френкеля.
- •15. Центры окраски. Радиационные дефекты.
- •16. Краевые дислокации. Винтовые дислокации.
- •17. Контур и вектор Бюргерса. Энергия дислокации. Источники дислокаций.
- •18. Описание энергетического состояния кристалла при помощи газа квазичастиц. Примеры квазичастиц.
- •Адиабатическое приближение Борна-Оппенгеймера.
- •Валентная аппроксимация
- •Одноэлектронное приближение
- •20. Одноэлектронное приближение. Метод Хартри-Фока.
- •V(r) – периодическая функция, период который совпадает с периодом кристаллической решётки.
- •21. Свойства волнового вектора электрона в кристалле. Свободный электрон и электрон в кристалле. Квазиимпульс. Энергетические зоны.
- •2) Рас электрон в кристалле.
- •22. Энергетический спектр электрона в кристалле. Модель Кронига-Пенни. Случаи сильной и слабой связи.
- •23. Заполнение зон электронами. Металлы, диэлектрики, полупроводники.
6. Ковалентные кристаллы (кк). Металлы. Плотнейшие упаковки.
КК - твёрдые тела, кристаллическая структура которых образована за счёт ковалентной связи (алмаз, кремний, германий, и алмаз подобные соединения)-полупроводники.
Ков. Связь- способность атомов связываться с другими атомами.
При образовании ковалентной связи атомы объединяют свои электроны как бы в общую "копилку" – молекулярную орбиталь, которая формируется из атомных оболочек отдельных атомов. Эта новая оболочка содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки.
Состояние
валентных электронов в ат-х описывается
атомной ВФ- ,
где r–расстояние от центра
ядра до места локализации электрона.
Если есть 2 электрона в двух атомах,
обозначаемых а и b, то
поведение электронов в этих атомах
будем описывать волновыми функциями
Ψaи
Ψb.
Поведение коллективизированных или
обобществлённых электронов будет
описываться молекулярной волновой
функцией. В качестве неё можно выбрать
Ψ, которая описывает
движение одного электрона в общем поле
атомов а и b. Такая волновая
функция - молекулярная орбиталь(МО),
являющейся линейной комбинацией атомных
орбиталей (ЛКАО):
,
где r–расстояние от центра
ядра до места локализации электрона.
Если есть 2 электрона в двух атомах,
обозначаемых а и b, то
поведение электронов в этих атомах
будем описывать волновыми функциями
Ψaи
Ψb.
Поведение коллективизированных или
обобществлённых электронов будет
описываться молекулярной волновой
функцией. В качестве неё можно выбрать
Ψ, которая описывает
движение одного электрона в общем поле
атомов а и b. Такая волновая
функция - молекулярная орбиталь(МО),
являющейся линейной комбинацией атомных
орбиталей (ЛКАО):

 – атомные волновые функции
– атомные волновые функции
 –const,
характеризующие долю участия в
молекулярной орбитали каждой из
орбиталей.
–const,
характеризующие долю участия в
молекулярной орбитали каждой из
орбиталей.
Для решения
задачи о поведении коллективизированных
электронов решается стационарное
уравнение Шрёдингера ,
где гамильтониан
,
где гамильтониан
 ,
где U – потенциальная
энергия системы, Е – полная энергия
системы,
,
где U – потенциальная
энергия системы, Е – полная энергия
системы,
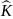 – кинетическая энергия. Оператор
состоит из кинетич энергии движения
ядер и электронов:
– кинетическая энергия. Оператор
состоит из кинетич энергии движения
ядер и электронов:

где mi– суммирование по всем электронам, Mk–по ядрам, Δ–лапласиан.
Для случая симметричной двухатомной молекулы существует симметричная и антисимметричная волновые функции:


Двум собственным значениям ВФ соответствует 2 значения энергииE1и Е2 уравнения Шредингера.
NB:
То есть при сближении атомов и перекрытии
их волновых функций происходит расщепление
их энергетического уровня
 на
2 близко расположенных молекулярных
уровня энергии
на
2 близко расположенных молекулярных
уровня энергии
 ,
при этом:
,
при этом:

 нтеграл
перекрытия, характеризующий степень
перекрывания атомных волновых функций
при взаимодействии (S<
1).
нтеграл
перекрытия, характеризующий степень
перекрывания атомных волновых функций
при взаимодействии (S<
1).
 - обменный интеграл: дополнительную
энергию взаимодействия, возникающую
из-за перераспределения электронной
плотности при перекрытии атомных
волновых орбиталей (А < 0). При этом так
как S< 1, аА< 0 уровень
Есимм понижается, а
уровень Еанти
повышаетсяотносительно исходного
уровня энергии Еа = Еb.
- обменный интеграл: дополнительную
энергию взаимодействия, возникающую
из-за перераспределения электронной
плотности при перекрытии атомных
волновых орбиталей (А < 0). При этом так
как S< 1, аА< 0 уровень
Есимм понижается, а
уровень Еанти
повышаетсяотносительно исходного
уровня энергии Еа = Еb.
Х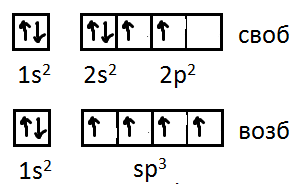 арактерной
особенностью КК является то количество
ковалентных связей, образуемых каждым
атомом со своими соседямировно количеству
неспаренных внешних электронов атома
в свободном состоянии или в возбуждённом
насыщенном.В этом смысле ковалентная
связь является насыщенной. Дело в том,
что атомы при взаимодействии могут
возбуждать друг друга и производить
распаривание электронов, то есть
переводить один из спаренных электронов
в свободную ячейку на незанятый
энергетический уровень.
арактерной
особенностью КК является то количество
ковалентных связей, образуемых каждым
атомом со своими соседямировно количеству
неспаренных внешних электронов атома
в свободном состоянии или в возбуждённом
насыщенном.В этом смысле ковалентная
связь является насыщенной. Дело в том,
что атомы при взаимодействии могут
возбуждать друг друга и производить
распаривание электронов, то есть
переводить один из спаренных электронов
в свободную ячейку на незанятый
энергетический уровень.
Характерная черта ковалентной связи - сильная направленность в пространстве, образуется в тех направлениях, в которых локализуется электронная плотность. Из-за направленности связи ковалентные кристаллы обладают высокой твёрдостью и хрупкостью.
Металлы
Металлические ТТ обладают: высокой электропроводностью, металлическим блеском, высокой пластичностью. Эти св-ва обусловлены наличием в металлах свободных электронов.
Металлическая связь возникает при взаимодействии атомов электроположительных элементов, внешние валентные электроны которых связаны с ядром относительно слабо. При образовании твердого состояния в результате перекрытия волновых функций металлических атомов, электроны обобществляются.
Большинство металлов кристаллизуется в структурах, отвечающей плотнейшей шаровой упаковке:
Плотнейшая гексагональная упаковка (2х слойная). Характеризуется структурной записью ABAB…
Плотнейшая кубическая упаковка (3х слойная). Запись: АВСАВС…
р азберем
образование этих упаковок.
азберем
образование этих упаковок.
Точки – центры шаров типа А
Х – центры шаров типа В
О – центры шаров типа С
АВАВ… . На исходный слой А накладывается второй слой так, чтобы проекции узлов сетки этого слоя занимали позиции В (слой В). Следующий 3-й слой располагается так, что проекции узлов сетки этого слоя занимают снова позиции А, и так далее. Аналогично можно построить упаковку АСАС… .
АВСАВС… . Строится аналогично.
Пустоты, которые окружают каждый шар бывают тетраэдрические и октоэдрические. Название происходят от типа геометрической фигуры, которая окружает шары.
