
- •1. Предмет фтт. Основные проблемы фтт.
- •2. Классификация твердых тел. Типы связи.
- •4. Молекулярные кристаллы(мк). Ионные кристаллы(ик).
- •6. Ковалентные кристаллы (кк). Металлы. Плотнейшие упаковки.
- •7. Кристаллические решетки. Вектор трансляции. Элементарная ячейка. Примитивная ячейка Вигнера-Зейтца.
- •8. Решетки Браве. Сингонии. Индексы Миллера.
- •9. Элементы симметрии кристаллов. Точечная группа симметрии. Пространственные группы симметрии.
- •10. Дифракция в кристаллах. Закон Вульфа-Брэгга. Основные дифракционные методы.
- •11. Обратная решетка: свойства, физический смысл.
- •12. Зоны Бриллюэна.
- •13. Классификация дефектов кристаллического строения.
- •14. Точечные дефекты: основные типы, равновесная концентрация, дефекты Шоттки и Френкеля.
- •15. Центры окраски. Радиационные дефекты.
- •16. Краевые дислокации. Винтовые дислокации.
- •17. Контур и вектор Бюргерса. Энергия дислокации. Источники дислокаций.
- •18. Описание энергетического состояния кристалла при помощи газа квазичастиц. Примеры квазичастиц.
- •Адиабатическое приближение Борна-Оппенгеймера.
- •Валентная аппроксимация
- •Одноэлектронное приближение
- •20. Одноэлектронное приближение. Метод Хартри-Фока.
- •V(r) – периодическая функция, период который совпадает с периодом кристаллической решётки.
- •21. Свойства волнового вектора электрона в кристалле. Свободный электрон и электрон в кристалле. Квазиимпульс. Энергетические зоны.
- •2) Рас электрон в кристалле.
- •22. Энергетический спектр электрона в кристалле. Модель Кронига-Пенни. Случаи сильной и слабой связи.
- •23. Заполнение зон электронами. Металлы, диэлектрики, полупроводники.
1. Предмет фтт. Основные проблемы фтт.
Тв. Тело – агрегатное состояние в-ва, характеризующееся стабильностью формы и хар-тор теплового движения атомов, совершающие малые колебания вокруг положения равновесия.
Типы ТТ:
Кристаллич – ТТ, у которого расположение атомов периодически повторяется и поверхностные грани которого с большей вероятностью располагаются друг относительно друга под вполне определенными углами. Для них характерен дальний порядок – кристаллич строгое упорядочение сохраняется во всем кристалле.
Аморф – ТТ, имеющие ближний порядок – упорядочение в связях сохраняется только в малой области вокруг выбранного атома.
Кристаллич состояние – устойчивое состояние с минимальной энергией.
Степень упорядоченн. АТ сильно зависит от усл их приготовления след-но их изучение предст. трудную задачу.
Предмет физконсост-наука о строении и св-вах тв (аморф и крист) и жид тел и происходящих в них явлениях.св-ва ТТ объясняются исходя из знаний об их атомно-мол строении и заканах движения их атом. (атомы, ионы, молекулы) и субатом (электрон, ядра) частиц.
Задачи ФТТ:
Создание материалов с заданными свойствами
Точное предсказание и их поведение в экстремальных ситуациях
Установление ресурса их работы
Физика твердого тела – наука о строении твердых тел, физических свойствах (механические, тепловые, электрические, диэлектрические, оптические, магнитные) и связанных с ним физических явлениях.
Существует 4 агрегатных состояния: газ, плазма, жидкость и твердое тело (конденсированное состояние). Твердое тело – агрегатное состояние, характеризующееся стабильностью формы и хар-ра теплового движения атомов, совершающих малые колебания около положения равновесия. Условие существования конденсированного состояния: Ек < U (Ек – кинетическая энергия, U – потенциальная энергия тт, жидкости). Жидкость состоит из молекул -> возможны перескоки молекул -> нет стабильности формы.
2. Классификация твердых тел. Типы связи.
Силы, удерживающие частицы в кристалле – силы электростатического притяжения между противоположно заряж частицами (электронами, ядрами) и силы отталкивания между одноименными заряж частицами (электроны и электроны, ядрами и ядрами).
Типы ТТ: металлич, ковалент, ионные, молекулярные кристаллы, кристаллы с водородной связью, которые являются ионными.
Хар-тер межмол сил взаимодействия определяется строением электрон оболочек взаимных атомов. В межатом связях у большинства элементов принимают участие внеш валент электроны. При взаимодействии атомов 1 сорта с атомами др, хар-тер хим связи определяется их способностью захватывать (отдавать) электроны – электроотрицательность атома: Х=1/2(I+Э), I – первый ионизационный потенциал, Э – энергия сродства к электрону.
Энергия, освобождающаяся при присоединении электрона к нейтральному невозбужденному атому с образованием отрицательного атома (аниона) энергия сродства атома электрона.
Основные типы связей: металлич, ионная, ковалент.
Ионная – связь между электроположит металлами и электроотриц неметаллми, она гетерополярная.
Металлич – между Ме и Ме.
Ковалент – между неМе и неМе.
Обе связи гомополярные.
Почти все ковалентные связи носят частично ионный характер. Доля этого характера составляет относит ионность. ОИ=1-exp(-0,25(Xa+Xb)2)
3. Энергия связи.
Расм. силы, удерживающие атомы в 2хатом молекуле.
Пусть имеем 2 атома А и В. Если атомы находятся далеко друг от друга, то у них свободное поведение. Энергия такой системы =0. Начинаем сближать атомы. При уменьшении расстояния между ними, енергия системы уменьшается по сравнению с сумар энергией изолированных атомов. Между атомами возникают силы притяжения. Этому соотвествует уменьшение потенц энергии U(r). при некотором расстоянии r=r0, U( r) =min. При дальнейшем сближениии действуют силы отталкивания.
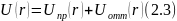
 – потенциал взаимодействия атомов.
– потенциал взаимодействия атомов.
Полная Еп взаимодействия может быть представлена в виде сумме двух членов с соответствующем потенциалом сил притяжения и отталкивания.
r0 – равновесное расстояние, ему соотвествует минимальная потенц энергия. На этом расстоянии образуется молекула АВ, состоящая из 2х атомов с наиболее стабильной конфигурацией. Ядра атомов такой молекулы совершают колебания с собственной частотой ω0.
При небольших отклонениях атомов от положения равновесия атомы колеблются как гармонические осцилляторы. Энергия колебания атомов в молекуле:

где n = 0,1,2,…
Энергия колебания – дискретная величина.
Глубина минимума U0равна энергии связи атомов в молекуле.
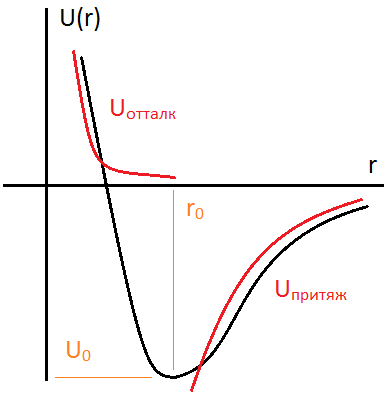
Энергиясвязи
=разности потенциальной энергии в
начальном и конечном состоянии.:
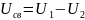 .
За начальное состояние - состояние,
когда частицы (атомы, молекулы или ионы)
находятся на достаточно больших
расстояниях друг от друга, и не
взаимодействуют между собой, то есть
U1=0. Конечное состояние
- равновесному расположению частиц при
Т = 0°К, то есть энергия связи
.
За начальное состояние - состояние,
когда частицы (атомы, молекулы или ионы)
находятся на достаточно больших
расстояниях друг от друга, и не
взаимодействуют между собой, то есть
U1=0. Конечное состояние
- равновесному расположению частиц при
Т = 0°К, то есть энергия связи
 .
.
Потенциал
сил притяжения можно представить в
виде:
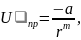 где а и m–константы,
большие 0.
где а и m–константы,
большие 0.
Для потенциала сил отталкивания, который обусловлен отталкиванием ядер взаимодействующих атомов:

Общее выражение для полной потенциальной энергии взаимодействующих частиц:
 - (энергия Ланде).
- (энергия Ланде).
Используя соотношение (2.5) можно найти равновесное расстояние r0.
Найдём
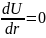


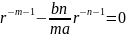
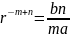
 – равновесное расстояние в молекуле
– равновесное расстояние в молекуле
 – энергия связи в двухатомной
молекуле.
– энергия связи в двухатомной
молекуле.
Зависимость энергии связи в кристаллах от межатомного расстояния r так же, как и в молекулах определяется двумя главными членами:
Притяжением атомов, обусловленное взаимодействием валентных электронов
Кулоновским отталкиванием внутренних оболочек атомных остовов и отталкиванием ядер.
