
- •Вопрос 1 - Основные понятия и определения химической термодинамики
- •Вопрос 2 - Первый закон термодинамики. Внутренняя энергия, теплота, работа. Конкретные примеры применения первого начала т/д к биосистемам.
- •Вопрос 3 - тепловой эффект химической реакции.
- •Вопрос 4 - Энтальпия. Стандартная энтальпия образования вещества. Расчет энтальпии химической реакции в нормальных условиях.
- •Вопрос 5 - Закон Гесса и следствия из него
- •Вопрос 6 - Второй закон термодинамики. Энтропия как функция состояния.
- •Вопрос 7 - энтропия как критерий направленности процессов в изолированных системах
- •Вопрос 8 - Статистический характер второго закона термодинамики
- •Вопрос 9- Расчет изменения энтропии в различных процессах.
- •Вопрос 10 – Третье начало термодинамики. Постулат Планка.
- •Вопрос11 – Энергия Гиббса. Изменение энергии Гиббса – критерий направленности самопроизвольного процесса в закрытой системе.
- •Вопрос 12 - Расчет стандартного изменения энергии Гиббса для химической реакции.
- •Вопрос 13 - Химический потенциал. Химические потенциалы компонента в идеальной газовой смеси.
- •Вопрос 14 - Химический потенциал компонента в идеальном и реальном растворах.
- •Вопрос 15 - Уравнение Клаузиуса-Клапейрона и его применение для решения задач.
- •Вопрос 16 - Правило фаз Гиббса.
- •Вопрос 17 - Диаграмма состояния однокомпонентной системы - графическое изображение фаз равновесных состояний при различных значениях параметров.
- •Вопрос 18 - Растворы. Способы выражения концентрации.
- •Вопрос 19 - Идеальные растворы. Закон Рауля.
- •Вопрос 20 - Растворимость газов в жидкостях. Закон Генри.
- •Вопрос 22 - Понижение температуры замерзания растворов нелетучих веществ. Криоскопия.
- •Вопрос 23 - Осмотическое давление растворов.
- •Вопрос 24 - Реальные растворы. Активность. Коэффициент активности. Стандартные состояния.
- •Вопрос 25 - Закон распределения вещества
- •Вопрос 26 - Обратимые и необратимые химические реакции. Условия химического равновесия.
- •Вопрос 27 - Уравнение изотермической реакции. Константа равновесия.
- •Вопрос 28 - Зависимость константы равновесия от температуры
- •Вопрос 29 - Уравнение изотермы и направление химической реакции.
- •Вопрос 31 - смещение химического равновесия
- •Вопрос 32 - Основные понятия химической кинетики
- •Вопрос 39 - Катализ. Механизм действия катализатора. Особенности ферментативного катализа
Вопрос 17 - Диаграмма состояния однокомпонентной системы - графическое изображение фаз равновесных состояний при различных значениях параметров.
Н а
фазовых диаграммах однокомпонентных
систем поля, по правилу фаз, соответствуют
однофазным состояниям, линии,
разграничивающие их — двухфазным, точки
пересечения линий — трёхфазным (эти
точки называют тройными точками).
а
фазовых диаграммах однокомпонентных
систем поля, по правилу фаз, соответствуют
однофазным состояниям, линии,
разграничивающие их — двухфазным, точки
пересечения линий — трёхфазным (эти
точки называют тройными точками).
Двухфазные линии, как правило, либо соединяют две тройные точки, либо тройную точку с точкой на оси ординат, отвечающую нулевому давлению. Исключение составляет линия жидкость-газ, заканчивающаяся в критической точке. При температурах выше критической различие между жидкостью и паром исчезает.
В соответствии с правилом фаз Гиббса: Фmax=1+2=3
В любой точке бивариантной системы: С=1-1+2=2
На линиях могут существовать 2 фазы: Ф=1-2+2=1
Тройная точка – критическая точка, исчезает различие м/у жидкой и газообразной фазой.
Р в точке – меньше атмосферного (кроме СО2).
Вопрос 18 - Растворы. Способы выражения концентрации.
Растворимость - способность вещества переходить в раствор. Состав растворителя выражается с помощью концентрации.
Раствор - гомогенная система, состоящая из двух и более компонентов, относительное количество которых можно изменять в определенных пределах.
Растворы бывают твердые, жидкие, газообразные. Делятся на электролиты (характеризуются высокой электропроводностью) и неэлектролиты.
С точки зрения ТД различают: идеальные и реальные растворы.
Растворитель - компонент в избытке, чаще жидкость; или компонент, находящийся в растворе в своем стандартном агрегатном состоянии.
Концентрация - относительное количество компонента в растворе.
Способы выражения концентрации:
1)массовая доля ωв= *100%
*100%
2)молярная доля хв=
3)молярная концентрация (молярность)
Св=
4)моляльность Сm=
5)Титр Т= ; 1 cм3
; 1 cм3
Вопрос 19 - Идеальные растворы. Закон Рауля.
При образовании жидкого раствора, когда компоненты раствора летучие, в газовой фазе будут присутствовать все компоненты раствора. Компоненты будут переходить из жидкой в газовую фазу до установления равновесия, жидкий раствор насыщенный пар. Так как давление насыщенного пара невелико, то считают, что он идеальный газ. Установлено, что идеальные растворы подчиняются закону Рауля.
Закон Рауля: парциальное давление
насыщенного пара компонента над идеальным
раствором пропорционально его молярной
доле в растворе
 , где Pi- парциальное давление i-го
компонента над раствором при Т=const;
, где Pi- парциальное давление i-го
компонента над раствором при Т=const;
 -
давление насыщенного пара над чистым
i-м компонентом при той же Т; Xi-
молярная доля i-го компонента в растворе.
-
давление насыщенного пара над чистым
i-м компонентом при той же Т; Xi-
молярная доля i-го компонента в растворе.
На практике часто используют растворы
нелетучих растворенных веществ (BaCl,
NaCl). Их молекулы практически отсутствуют
в газовой фазе, тогда P=P1(P насыщ.
пара=P пара растворителя). Закону Рауля
будет подчиняться только растворитель.
X1+X2=1
X1<1 P1< (т.е. образование раствора нелетучего
вещества сопровождается понижением P
пара растворителя над раствором по
сравнению с чистым растворителем).
Рассмотрим
бинарный раствор: X1+X2=1;
Х1=1-Х2; Р1=
*(1-Х2)=
-
*Х2;
(т.е. образование раствора нелетучего
вещества сопровождается понижением P
пара растворителя над раствором по
сравнению с чистым растворителем).
Рассмотрим
бинарный раствор: X1+X2=1;
Х1=1-Х2; Р1=
*(1-Х2)=
-
*Х2;
( -Р1)/ =Х2 - закон Рауля
Относительное понижение давления пара над раствором по сравнению с чистым растворителем равно молярной доле растворенного вещества.
Закон Рауля- критерий идеальности
раствора. Растворы, подчиняющиеся закону
Рауля при любых составах и температурах,
называются идеальными. Идеальному
поведению соответствует выражение для
химического потенциала компонентов
раствора:
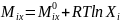 ;
;
 -стандарнтый
химический потенциал или химический
потенциал чистого компонента.
-стандарнтый
химический потенциал или химический
потенциал чистого компонента.
