
- •Вопрос 1 - Основные понятия и определения химической термодинамики
- •Вопрос 2 - Первый закон термодинамики. Внутренняя энергия, теплота, работа. Конкретные примеры применения первого начала т/д к биосистемам.
- •Вопрос 3 - тепловой эффект химической реакции.
- •Вопрос 4 - Энтальпия. Стандартная энтальпия образования вещества. Расчет энтальпии химической реакции в нормальных условиях.
- •Вопрос 5 - Закон Гесса и следствия из него
- •Вопрос 6 - Второй закон термодинамики. Энтропия как функция состояния.
- •Вопрос 7 - энтропия как критерий направленности процессов в изолированных системах
- •Вопрос 8 - Статистический характер второго закона термодинамики
- •Вопрос 9- Расчет изменения энтропии в различных процессах.
- •Вопрос 10 – Третье начало термодинамики. Постулат Планка.
- •Вопрос11 – Энергия Гиббса. Изменение энергии Гиббса – критерий направленности самопроизвольного процесса в закрытой системе.
- •Вопрос 12 - Расчет стандартного изменения энергии Гиббса для химической реакции.
- •Вопрос 13 - Химический потенциал. Химические потенциалы компонента в идеальной газовой смеси.
- •Вопрос 14 - Химический потенциал компонента в идеальном и реальном растворах.
- •Вопрос 15 - Уравнение Клаузиуса-Клапейрона и его применение для решения задач.
- •Вопрос 16 - Правило фаз Гиббса.
- •Вопрос 17 - Диаграмма состояния однокомпонентной системы - графическое изображение фаз равновесных состояний при различных значениях параметров.
- •Вопрос 18 - Растворы. Способы выражения концентрации.
- •Вопрос 19 - Идеальные растворы. Закон Рауля.
- •Вопрос 20 - Растворимость газов в жидкостях. Закон Генри.
- •Вопрос 22 - Понижение температуры замерзания растворов нелетучих веществ. Криоскопия.
- •Вопрос 23 - Осмотическое давление растворов.
- •Вопрос 24 - Реальные растворы. Активность. Коэффициент активности. Стандартные состояния.
- •Вопрос 25 - Закон распределения вещества
- •Вопрос 26 - Обратимые и необратимые химические реакции. Условия химического равновесия.
- •Вопрос 27 - Уравнение изотермической реакции. Константа равновесия.
- •Вопрос 28 - Зависимость константы равновесия от температуры
- •Вопрос 29 - Уравнение изотермы и направление химической реакции.
- •Вопрос 31 - смещение химического равновесия
- •Вопрос 32 - Основные понятия химической кинетики
- •Вопрос 39 - Катализ. Механизм действия катализатора. Особенности ферментативного катализа
Вопрос 3 - тепловой эффект химической реакции.
Тепловым эффектом химической реакции называется количество теплоты, выделяющееся или поглощаемое в ходе химической реакции, протекающей при постоянстве давления или объема в изотермических условиях, при отсутствии всех видов работ, кроме работы расширения.
Различают изохорный и изобарный тепловые эффекты (QP- изобарный; и QV- изохорный)
V,T=const; QV=ΔU; QV-функция состояния
p,T=const
QP=ΔU+pΔV=U2-U1+p(V2-V1)=(U2+pV2)-(U1+pV1)=H2-H1=ΔH
U,p,V зависят только от состояния системы, но не зависят от того, как оно было достигнуто.
H=U+pV - энтальпия, функция состояния. Характеризует энергетическое состояние системы в изобарно-изотермических условиях.
QP=H2-H1=ΔH ; δQP=dH
В термохимическом уравнении также указываются агрегатные состояния вещества, т.к. от них зависит Q.
Различают экзо- и эндотермические реакции.
Экзотермические сопровождаются выделением тепла из системы во внешнюю среду, ΔrH<0.
Эндотермические реакции сопровождаются поглощением энергии системой. ΔrH>0.
Тепловой эффект может быть отнесен как к реакции (кДж), так и к любому участнику реакции (кДж/моль).
когда газ ведет себя как идеальный при p=1атм, то pΔV=ΔνRT
ΔrH= ΔrU+ ΔνгRT
QP= QV+ ΔνгRT
ΔrH= Δr(U+pV)= ΔrU+p ΔrV; ΔrV - изменение V в ходе реакции, связанное с ΔV газообразных участников. ΔrV= ΔrVгаз
VЖ H20=0,018
 ; VГ H20=22,4
=> пренебрегаем VЖ
H20 когда
газ ведет себя как идеальный при p=1атм,
то pΔV=ΔνRT
; VГ H20=22,4
=> пренебрегаем VЖ
H20 когда
газ ведет себя как идеальный при p=1атм,
то pΔV=ΔνRT
ΔrH ΔrU
когда реакция протекает в конденсированной
фазе или реакция протекает без изменения
числа молей газообразных участников
реакции ΔrνГ=
ΔrU
когда реакция протекает в конденсированной
фазе или реакция протекает без изменения
числа молей газообразных участников
реакции ΔrνГ= К-
п
К-
п
Тепловой эффект химической реакции может быть определен путем непосредственных калориметрических измерений, либо расчетным путем.
QПРЯМ=-QОБРАТН - закон Лавуазье-Лапласа
ΔrH ПРЯМ=- ΔrH ОБРАТН
Количество теплоты, поглощенное в результате прямого процесса, равно количеству теплоты, выделенной при обратном процессе.
Вопрос 4 - Энтальпия. Стандартная энтальпия образования вещества. Расчет энтальпии химической реакции в нормальных условиях.
Энтальпия химической реакции - изобарный тепловой эффект.
QP=ΔH ; δQP=dH ; H=U+pV
H - функция состояния
ΔrH ПРЯМ=- ΔrH ОБРАТН - закон Лавуазье-Лапласа для энтальпий
ΔrH в общем случае зависит от T, p, состояния вещества, поэтому ΔrH необходимо относить к одинаковым условиям, то есть стандартизировать.
Стандартные условия: p=1атм; T=298К
Стандартное состояние (то есть при стандартных условиях):
-для индивидуальных твердых и жидких веществ - физическое состояние - наиболее устойчивая т/д модификация при p=1атм и любой T. С-графит; ромбическая сера
-для индивидуальных газов - идеальный газ, p=1атм, любая T
Стандартная энтальпия образования - тепловой эффект образования 1 моль данного соединения из простых веществ, находящихся в той модификации и в том агрегатном состоянии, которые устойчивы при данной Т и р=1атм.
Энтальпия образования любого простого
вещества в стандартном состоянии равна
нулю. При любой Т: Δf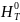 (A)=0
(A)=0
Как правило, стандартная энтальпия относится к стандартным условиям, её значения - справочные данные.
Δf определяется по закону Гесса или калориметрически.
Энтальпию реакции между веществами, находящимися в стандартных состояниях, при Т и р=1атм, называют стандартной энтальпией реакции Δr
При p=1атм, T 298К расчет Δr проводится по уравнению Кирхгофа.
T>298К, участники реакции
не испытывают фазовых превращений,
тогда уравнение Кирхгофа имеет вид:
Δr
=
Δr +
+ rCpdT
, где ΔrCp
- изменение теплоемкости в ходе реакции.
rCpdT
, где ΔrCp
- изменение теплоемкости в ходе реакции.
ΔrCp=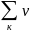 кСp
к-
кСp
к- нСp
н
нСp
н
Сp=a+bT+cT-2
Сp=
Из справочников находят теплоемкости участников реакции, затем рассчитывают ΔrCp=Δa+ΔbT+ΔcT-2 . Так как расчет достаточно громоздкий, применяют различные степени приближения:
Cp=f(T);
 Δr
(пренебрежение зависимостью C
от T)
Δr
(пренебрежение зависимостью C
от T)Считаем, что ΔrCp=Δr

ΔrCp= к к- н н
Тогда Δr = Δr + Δr (T-298)
Если в ходе реакции хотя бы один участник претерпевает фазовое превращение, то необходимо учитывать его тепловой эффект и изменение теплоемкости вещества.
