
- •Тема 1 Електролітична дисоціація та розчини електролітів
- •Тема 2 Електропровідність розчинів електролітів
- •Р ис.1.Залежність питомої електропровідності від концентрації
- •3. Закон Оствальда для слабких електролітів. Константа дисоціації визначається за рівнянням Оствальда:
- •4.Рівняння Нернста.
- •Рівняння ізотерми для електродної реакції можна записати:
- •Відбувається реакція
- •На газовому хлорному електроді
- •Кисневий електрод за конструкцією подібний до водневого - платина контактує з киснем та його іонами ( )
- •Тема 5 Електроліз
- •Анод – позитивний електрод – процес окислення (Рис.1.)
- •Катод – негативний електрод – процес відновлення
- •Тема 6 Корозія металів і методи захисту від корозії.
- •Кислий розчин
- •2. Різні види електрохімічної корозії.
3. Закон Оствальда для слабких електролітів. Константа дисоціації визначається за рівнянням Оствальда:
![]()
тоді

Закон Оствальда в такому вигляді застосовується тільки для одно –одновалентних слабких електролітів.
Визначення електропровідності називається кондуктометричним визначенням.
Кондуктометричне визначення електропровідності можна застосовувати для того щоб визначити:
вміст солей в різних розчинах;
основність кислот;
розчинність малорозчинних електролітів;
концентрацію електролітів в розчинах шляхом титрування.
Широко використовується кондуктометричне титрування – це визначення концентрації електроліту в розчині за допомогаю вимірювання електропровідності при титруванні.
Застосовується в випадку мутних або забарвлених розчинів.
П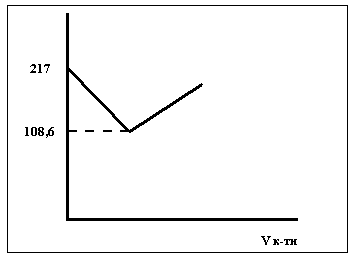 ри
титруванні розчину NaOH розчином НСl
замість рухливих іонів ОН-
в розчин будуть поступати іони Cl-,
які мають меншу рухливість, що приведе
до зменшення електропровідності
(Рис.4.).
ри
титруванні розчину NaOH розчином НСl
замість рухливих іонів ОН-
в розчин будуть поступати іони Cl-,
які мають меншу рухливість, що приведе
до зменшення електропровідності
(Рис.4.).
Рис.4. Крива кондуктометричного титрування розчину NaOH розчином HCl
NaOH + HCl → NaCl + H2O
![]() =
43,3 + 174 = 217,4
=
43,3 + 174 = 217,4
![]()
Після точки еквівалентності з`являються високорухливі іони Н+, тому λ знову збільшується.
Тема 3
Електрохімічні системи та електрорушійні сили
Електрохімічні системи.
Подвійний електричний шар. Електродний потенціал.
Гальванічний елемент.
Рівняння Нернста.
1. Електрохімічні системи. Процеси, які супроводжуються взаємоперетворенням хімічної та електричної форм енергій називаються електрохімічними. Вони широко представлені в різних областях народного господарства: електрохімічні способи одержання багатьох металів, важливих неорганічних та органічних сполук, рафінування та електрохімічні способи обробки металів, одержання гальванопокриттів для захисту виробів від корозії, хімічні джерела струму і т.д. В свою чергу системи, в яких відбуваються електрохімічні процеси, теж називаються електрохімічними. Для даних систем характерно, що хімічна енергія перетворюється в електричну та навпаки в наслідок не будь-якої, а тільки окисно-відновної реакції, тобто йде обмін електронами між окисником і відновником. Відомі електрохімічні системи двох типів: хімічні джерела струму (хімічна енергія перетворюється в електричну) та електролізери (електрична енергія в хімічну).
Будь-яка електрохімічна система складається з наступних складових частин:
1. Електроди – дві пластинки, електронні провідники або провідники І роду.
2. Металевий провідник, який з’єднує електроди.
3. Електроліти (розчини або розплави) – іонні провідники, провідники ІІ роду.
Робота будь-якої електрохімічної системи відбувається за рахунок того, що металевий провідник утворює зовнішній ланцюг та забезпечує проходження струму між електродами а електроди занурені в електроліти і складають разом з ними внутрішній ланцюг.
В хімічних системах обмін електронами між окисником і відновником відбувається при їх безпосередньому контакті, а в електрохімічних системах електрони переходять від відновника до окисника по провіднику першого роду, тобто окисно-відновна реакція розділена в просторі: на аноді відбувається окислення, на катоді - відновлення. В цьому ї є різниця в проведенні однієї окисно-відновної реакції хімічним та електрохімічним способом.
2. Подвійний електричний шар. Електродні потенціали. Для розуміння суті електрохімічних процесів необхідно детально розглянути явища, які відбуваються на межі розділу фаз електрод-розчин. Якщо металевий електрод занурити в будь-який полярний розчинник на межі метал-розчин відбуваються два процеси: іонізація металу і сольватація іонів металу розчинником.
Металічна кристалічна решітка містить у вузлах атоми і іони, які находяться в рівновазі з електронним газом. Сольватація (гідратація, якщо розчинник – вода) іонів металу полярними молекулами розчинника йде за іон-дипольним механізмом, в наслідок якого відбувається перехід іонів металу із кристалічної решітки в розчин, а електрони залишаються на поверхні металу (вони не сольватуються і не переходять в розчин). Для кожного з цих процесів можна написати рівняння реакції:
![]() (іонізація
металу)
(іонізація
металу)
![]() (сольватація іонів металу)
(сольватація іонів металу)
Сума цих рівнянь дає рівняння, яке відображає взаємодію металу з розчинником:
![]() ,
,
де МеLxz+ - сольватований іон металу.
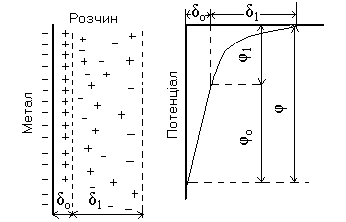
В наслідок цієї взаємодії межа розділу фаз метал – розчин характеризується визначеною будовою: на металі зосереджується негативний заряд за рахунок електронів, які залишаються в поверхневому шарі, а розчин заряджується позитивно іонами металу, які щільно прилягають до поверхні електроду. Утворюється так званий подвійний електричний шар (ПЕШ), подібний до плоского конденсатора (Рис.3.1а). Як і між обкладками конденсатору, так і на межі розділу метал-розчин виникає стрибок потенціалу або електродний потенціал – φ.
a б
Рис.3.1. Будова подвійного електричного шару на межі метал-розчин (а) і розподілення потенціалу в іонному шарі (б)
Іонну обкладинку подвійного електричного шару умовно поділяють на дві частини:
Щільний шар або шар Гельмгольца, який утворений іонами, що розміщені впритул до поверхні металу. Товщина щільного шару δо дорівнює величині радіусу іона.
Дифузійний шар, товщина якого δ1 залежить від концентрації електроліту. Так, товщина дифузійного шару в дуже розведених розчинах досягає декількох тисяч ангстрем, а в концентрованих розчинах зменшується до десятків або одиниць ангстрем.
В щільному шарі ПЕШ зміна потенціалу φо зі збільшенням відстані від електроду лінійна, в дифузійному шарі потенціал φ1 змінюється за експоненціальним законом (див. рис.3.1.б). Сумарний потенціал можна представити як
φ = φо + φ1 (3.1)
В момент занурення металу в розчин відбувається процес розчинення металу зі швидкістю V1, але при зростанні концентрації іонів металу в приелектродному шарі розвивається зворотній процес – кристалізація металу (V2), тобто надлишок іонів металу, рекомбінуючи з електронами у вигляді електронейтральних атомів, осаджується на поверхні електроду – відбувається добудова металічної кристалічної решітки. В момент рівності швидкостей процесу розчинення металу та процесу кристалізації металу (V1=V2), настає динамічна рівновага. Електродний потенціал, який виникає в момент рівноваги називається рівноважним, а відповідна йому концентрація іонів металу у розчині – рівноважною.
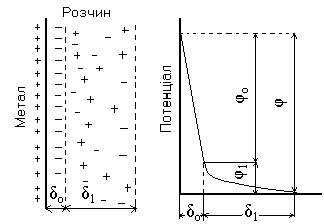
Метали, іони яких доволі легко переходять в розчин, будуть заряджатися негативно, а метали, які практично не розчиняються (Ag, Pt, Au і т.д.) можуть отримувати іони з розчину та заряджатися при цьому позитивно, тоді ПЕШ характеризується протилежним розподіленням зарядів (Рис.3.2).
а б
Рис.3.2. Будова подвійного електричного шару на межі розчин-малоактивний метал (а) і розподілення потенціалу в іонному шарі (б)
Аналогічна взаємодія відбувається і при зануренні металу не тільки в чистий розчинник, але і в розчин.
Подвійний електричний шар виникає також при дотиканні двох металів, різниця потенціалів при цьому називається контактним потенціалом. Контактні потенціали входять у величину електродних потенціалів і самостійно не враховуються.
Стрибки потенціалів, що виникають на межі дотику двох електролітів або розчинів, які містять один електроліт різної концентрації, називаються дифузійними. Точно виміряти величину дифузійних потенціалів важко, тому щоб зовсім позбавитись від їх впливу з`єднують два різних електроліти сольовим містком, заповненим розчином КСl, іони якого характеризуються приблизно однаковою рухливістю.
На практиці дослідження електродних потенціалів – це вивчення електрорушійних сил гальванічних елементів.
3. Гальванічний елемент (ГЕ) – це пристрій для перетворення хімічної енергії будь-якої окисно-відновної реакції в електричну.
Розглянемо роботу електрохімічного елемента Даніеля-Якобі, який складається з двох електродів: цинкового та мідного, занурених в розчини відповідних солей та замкнутих через зовнішній ланцюг (Рис.3.3).
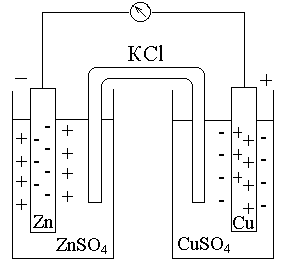
Рис.3.3. Схема гальванічного елемента Даніеля-Якобі
Електричний струм в елементі виникає в наслідок окисно-відновної реакції:
Zn + CuSO4 → ZnSO4 + Cu
Контакт між електродами здійснюється за допомогою будь-якого провідника першого роду, а контакт між електролітами за допомогою агар-агарового містка, приготовленого на розчині КСl. Ця межа поділяє гальванічний елемент на два напівелемента. На одному з електродів (катоді) йде процес відновлення:
K (+) Cu+2 + 2e → Cuo,
А на іншому електроді (аноді) процес окислення:
A (-) Zno – 2e → Zn+2
Схематично гальванічний елемент прийнято записувати в наступній формі:
(-)Zn│ZnSO4║CuSO4│Cu(+)
Зліва записується негативний електрод (анод), далі склад розчину, в який він занурений, потім склад другого розчину та позитивний електрод (катод). Місця виникнення різниці потенціалів показані вертикальними рисками, подвійна риска означає, що дифузійний потенціал усунений та його можна не враховувати.
В даному ГЕ спостерігається три міжфазних стрибка потенціалів – φ(Zn/Zn+2), φ(Cu/Cu+2), φ(Cu/Zn), наявність яких свідчить про те, що даний елемент є нерівноважною електрохімічною системою та при накладанні деякої різниці потенціалів від зовнішнього джерела постійного струму спостерігається відсутність струму в елементі, тобто встановлюється рівновага. Різниця рівноважних потенціалів називається електрорушійною силою (ЕРС) хімічного джерела струму та позначається через Е.
Е = φК - φА (3.2)
де φК, φА – електродний потенціал катода та анода відповідно.
