
- •Предмет теплотехніки. Роль теплотехніки в науково-технічному прогресі. Проблеми економії паливно-енергетичних ресурсів, зниження норм витрати теплоти і палива.
- •Рух і його форми. Енергія та її види. Предмет термодинаміки. Робочі тіла. Поняття про ідеальні та реальні гази. Мета введення поняття про ідеальний газ.
- •Ентальпія. Потенційна енергія тиску. Їх фізичний зміст.
- •Теплота і робота. Їх фізичний зміст та обчислення. Робота розширення та стиснення. Позитивний і негативний напрямок теплоти і роботи. Термодинамічна система та її типи.
- •Перший закон термодинаміки, його зміст, основні формулювання. Принципи еквівалентності енергії. Математичний вираз першого закону термодинаміки в різних формах.
- •Вільна і зв’язана енергія робочого тіла. Поняття про енергію. Енергія Гельмгольца і енергія Гіббса. Їх фізичний зміст і математичні залежності. Енергетична модель робочого тіла.
- •Термодинамічний стан. Параметри стану. Термодинамічний метод. Екстенсивні та інтенсивні параметри стану. Питомі та мольні термодинамічні величини. Рівноважні та нерівноважні стани.
- •Чотири загальні властивості параметрів стану.
- •Термодинамічні потенціали. Чотири потенціали Гіббса. Диференційні рівняння термодинамічних потенціалів.
- •Теплоємність системи (робочого тіла). Питома теплоємність, фізичний зміст, одиниці виміру, залежність між питомими теплоємностями. Залежність теплоємності газу від температури.
- •Середня та дійсна теплоємність. Визначення середньої теплоємності газу при криволінійній та прямолінійній залежності її від температури. Таблиця теплоємностей.
- •Середня уявна молекулярна маса, газова постійна. Густина та питомий об’єм суміші ідеальних газів, парціальних тиск компонентів сумішей ідеальних газів, співвідношення для їх знаходження.
- •Властивості реальних газів. Рівняння Ван Дер Ваальса для 1 кг газу. Внутрішній молекулярний тиск газу. Зміст константи в рівнянні Ван Дер Ваальса.
- •Термодинамічний процес. Рівноважний та нерівноважний процес. Графічний метод дослідження процесу. Прямий і зворотній процеси.
- •Оборотний та необоротний процеси. Умови проходження оборотних процесів. Облік незворотності в дійсних процесах.
- •Визначення значень зміни внутрішньої енергії, ентальпії та ентропії робочого тіла при зміні його стану.
- •Графічний метод вивчення термодинамічних процесів. Pv та ts –діаграми та їх властивості.
- •Ентропія робочого тіла. Фізичний зміст. Розмірність. Математичний вираз.
- •Характеристики термодинамічного процесу. Теплота і робота. Властивості їх диференціалів. Графічне зображення для розімкнутих та кругових процесів.
- •Характеристики термодинамічного процесу. Коефіцієнт перетворення енергії в процесаі (кпе). Коефіцієнт використання термодинамічного потенціалу в процесі (квп).
- •Політропний процес в ідеальних газах. Залежність для зміни параметрів стану робочого тіла.
- •Обчислення роботи. Значення політропи для основних термодинамічних процесів. Визначення показника ступеня політропи.
- •Другий закон термодинаміки, його зміст та основні формулювання. Умови перетворення теплоти в роботу в безперервно діючому тепловому двигуні.
- •Кругові процеси чи цикли. Цикли прямі та зворотні, оборотні та необоротні. Термічний ккд циклу.
- •Прямий оборотний цикл Карно. Зображення циклу на pv та ts –діаграмах: вивести вираз для термічного ккд циклу. Аналіз циклу на основі виразу термічного ккд.
- •З воротний оборотний цикл Карно. Холодильний коефіцієнт.
- •Теорема Карно.
- •Узагальнений (регенеративний цикл) Карно та його ккд. Необоротний цикл Карно та його ккд.
- •Властивості оборотного циклу. Перший та другий інтеграл Клаузіуса.
- •Зміна ентропії ізольованої кінцевої системи при оборотних на необоротних процесах. Математичний вираз другого закону термодинаміки. Принцип зростання ентропії.
- •Ексергія теплоти та фізичний зміст ентропії. Рівняння Гюі-Стодоли. Визначення зміни ексергії в основних термодинамічних процесах. Ексергетичний ккд.
- •Ентропія води, вологої та сухої, насиченої та перегрітої пари. Їх знаходження.
- •Знаходження питомого об’єму та густини вологої насиченої пари. Знаходження ентальпії та внутрішньої енергії вологої насиченої перегрітої пари.
- •Hs діаграма водяної пари, її побудова та застосування. Визначення параметрів стану вологої насиченої, сухої насиченої та перегрітої пари на hs діаграмі.
- •Ізобарний процес зміни стану водяної пари. Зображення процесу на pv, hs та ts діаграмах. Визначення роботи зміни внутрішньої енергії та параметрів стану пари.
- •Адіабатний процес зміни стану водяної пари. Зображення процесу на pv, hs та ts діаграмах. Визначення роботи зміни об’єму та параметрів стану.
- •Рівняння першого закону термодинаміки для потоку, фізичний зміст кожного члена рівняння, різні форми рівняння.
- •Швидкість витоку ідеального газу при адіабатному процесі. Рівняння для його визначення та аналізу. Швидкість витоку водяної пари та її визначення.
- •Секундна витрата ідеального газу при витоку. Рівняння для визначення та його аналіз. Гіпотеза Сен-Венана. Критичне відношення тисків при витоку ідеальних газів, рівняння для його визначення.
- •Вибір профілю сопла в залежності від критичного відношення тисків. Виток газу через комбіноване сопло. Розрахунок комбінованого сопла.
- •Витоки водяної пари та його особливості. Визначення швидкості водяної пари при різних умовах. Виток газів та пари при наявності тертя.
- •Дроселювання реальних газів. Ефект Джоуля-Томпсона. При яких умовах ефект дроселювання додатній, від’ємний чи рівний нулю. Інверсія, точка інверсії, температура інверсії.
- •Дослідження дроселювання водяної пари різних станів по hs діаграмі.
- •Причини виникнення двз зі змішаним згоранням палива. Теоретичний цикл цих двигунів. Зображення циклу в pv та ts –діаграмах, характеристики циклу, термічний ккд циклу, аналіз ккд циклу.
- •Принципова схема паросилової установки, що працює по циклу Ренкіна. Зображення циклу в pv та ts –діаграмах.
- •Вплив початкових та кінцевих параметрів пари на ккд циклу паросилової установки. Дати аналіз з використанням hs –діаграми. Відносний внутрішній ккд циклу.
- •Принципова схема паросилової установки, що працює по теплофікаційному циклу. Зображення циклу в pv та ts –діаграмах. Коефіцієнт використання теплоти циклі, порівняння з конденсаційним циклом.
- •Цикл газотурбінної установки(гту). Переваги гту перед двз. Термічний ккд гту.
- •Вологе повітря. Визначення. Абсолютна та відносна вологість, вологоємність. Точка роси. Hd –діаграма вологого повітря. Основні процеси вологого повітря в hd –діаграмі.
- •Відмінність паротурбінної установки від двз. Цикл Карно для насиченої пари.
- •Цикл паротурбінної установки з проміжним перегрівом пари. Економічність проміжного перегріву пари. Термічний ккд циклу, факти, які впливають на його величину.
- •Регенеративний цикл паросилової установки. Ціль використання. Ефективність застосування циклу. Питома витрата пари для регенеративного циклу.
- •Цикл теплового насосу. Доцільність використання теплового насосу. Опалювальний коефіцієнт. Його визначення. Переваги використання теплового насосу.
- •Цикл теплового насосу. Призначення та область застосування теплових насосів. Опалювальний коефіцієнт та його визначення
Ентропія робочого тіла. Фізичний зміст. Розмірність. Математичний вираз.
Поняття ентропії
Ще в 1875 році німецький вчений Гей-мгольц запропонував гіпотезу, в якій сказа-но, що внутрішня енергія U складається з двох частин:
U=F+TS (1)
F – вільна енергія, Дж.
TS – зв’язана енергія, Дж.
T- абсолютна температура, К.
S – ентропія, . s – питома ентропія, .
Поняття ентропія було введено ще в 1850 році німецьким вченим Клаузіусом, який сказав, що існує функція відношен-ня елементарної кількості теплоти δQ до абсолютної температури T, яку він по-значив dS і назвав S-ентропія.
, ;
, .
Фізичний зміст ентропії:
Це є частина внутрішньої енергії робо-чого тіла, яка припадає на 1К його темпе-ратури і яка під впливом теплоти не пере-творюється в роботу.
 Q=L;
Q=L; 
Ентропія характеризує нероботоздатність робочого тіла.
Характеристики термодинамічного процесу. Теплота і робота. Властивості їх диференціалів. Графічне зображення для розімкнутих та кругових процесів.
Термодинамічний процес – це сукупність змін термодинамічного стану системи.
Під час вивчення термодинамічних процесів широко використовується графічний метод дослідження термодинамічних процесів. Для цього використовують дві системи координат:
рv
р – абсолютний тиск;
– абсолютний тиск;
v – питомий об’єм.
рv-діаграма
Особливістю цієї системи координат є те, що елементарна площа площадки є рdv, тому:

Площа, обмежена кривою процесу, крайніми координатами і віссю абсцис, являє собою в деякому масштабі роботу цього процесу.
T s
s
T – абсолютна температура;
s – питома ентропія.
Ts-діаграма
 - кількісна залежність.
- кількісна залежність.

У системі координат (T,s) площа, обмежена кривою процесу, крайніми ординатами і віссю абсцис в деякому масштабі являють собою теплоту процесу. Є чотири величини з однаковою розмірністю :
 ,
,
 ,
,
,
,
 .
.
Значить, значення всіх цих величин можна відкласти на одній осі в системі координат, кожна з них характеризує енергію.
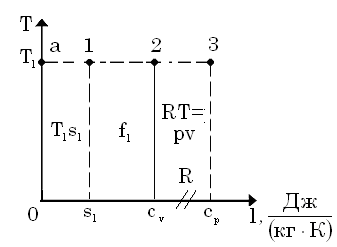
Графічне зображення енергетичної моделі робочого тіла
Площа
 – внутрішня енергія.
– внутрішня енергія.
Площа
 – питома вільна енергія.
– питома вільна енергія.
Площа
 – питома ентальпія.
– питома ентальпія.
Характеристики термодинамічного процесу. Коефіцієнт перетворення енергії в процесаі (кпе). Коефіцієнт використання термодинамічного потенціалу в процесі (квп).
Характеристики термодинамічного процесу
Зміна параметрів стану не залежить від шляху, за яким термодинамічна система змінює свій стан. Характеристиками процесу називаються такі величини, зміна яких залежить від характеру, шляху, за яким змінює свій стан система. Їх є чотири:
Робота
Розглянемо pv-діаграму.
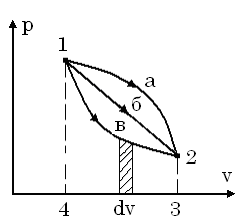

В
ній є дві точки, 1 і 2, які характеризують
початковий і кінцевий стан системи. Між
двома точками можна провести необмежену
кількість кривих ліній, тобто,
термодинамічних процесів. Таким чином,
можна провести 1а, 1б, 1в і так далі. Ми
знаємо, що в pv-діаграмі площа під кривою
процесу являє собою в деякому масштабі
робоу. Робота залежить від характеру
процесу. Так як з математики відомо, що
якщо значення підінтегральної функції
залежить від шляху інтегрування, то
підінтегральна функція
 є неповний диференціал.
є неповний диференціал.

Теплота

В Ts-діаграмі площа під кривою процесу є теплота.

 є також неповний диференціал.
є також неповний диференціал.

Коефіцієнт використання термодинамічного потенціалу (КВП)
В
загальному вигляді термодинамічний
потенціал позначається літерою А для
маси m кг. КВП позначається літерою
 ,
де Х характеризує характер процесу. КВП
являє собою відношення зміни
термодинамічного потенціалу в процесі
до його значення в початковому стані.
,
де Х характеризує характер процесу. КВП
являє собою відношення зміни
термодинамічного потенціалу в процесі
до його значення в початковому стані.


Знак мінус означає, що в процесі перетворення енергії хаотичного руху в енергію направленого руху термодинамічний потенціал зменшується.

Коефіцієнт перетворення енергії (КПЕ)
Позначається
 ,
де t – це перша буква від англ.
“transportation”. І тому КПЕ є відношення
роботи процесу до енергії хаотичного
руху, яка перетворюється в даному
процесі.
,
де t – це перша буква від англ.
“transportation”. І тому КПЕ є відношення
роботи процесу до енергії хаотичного
руху, яка перетворюється в даному
процесі.
 для 1 кг
для 1 кг  для m кг
для m кг  .
.
Ізохорний процес в ідеальних газах. Рівняння процесу в PV та TS координатах. Зображення процесу на PV та TS –діаграмах. Залежність для змінів параметрі стану робочого тіла. Обчислення теплоти, роботи, зміни внутрішньої енергії. Коефіцієнт перетворення енергії в процесаі (КПЕ). Коефіцієнт використання термодинамічного потенціалу в процесі (КВП).Енергетичний баланс процесу.
Ізохорний процес
Ізохорним називають процес, який протікає при сталому об’ємі.
Рівняння ізохорного процесу в pv-діаграмі: v=const.
У Ts–діаграмі:
 .
.
У pv-діаграмі це вертикальна пряма. У Ts-діаграмі це логарифмічна крива.
1-2 – ізобара P=const.
1-3 – ізохора V=const.
Якщо у Ts-діаграмі через одну і ту ж то-чку проходить і ізобара, і ізохора, то ізобара йде більш полого, а ізохора – більш круто.
;
 ;
.
;
.
Написати співвідношення для па-раметрів стану.
 поділимо на
поділимо на
 .
.
Отримаємо:
 .
.
 .
.
 .
.
.
.
 .
;
.
;
 ;
;
 .
.
d(pv)=vdp+pdv;; pdv=0;
 .
.
Схема енергобалансу:
 .
.
КВП:  .КПЕ:
.КПЕ:  .
.
Це
в тому випадку, якщо розглядати роботу
розширення:

Ізобарний процес в ідеальних газах. Рівняння процесу в PV та TS координатах. Зображення процесу на PV та TS –діаграмах. Залежність для змінів параметрі стану робочого тіла. Обчислення теплоти, роботи, зміни внутрішньої енергії. Коефіцієнт перетворення енергії в процесаі (КПЕ). Коефіцієнт використання термодинамічного потенціалу в процесі (КВП).Енергетичний баланс процесу. Відносне розміщення ізохори та ізобари на TS –діаграмі.
Ізобарним називають процес, який протікає при сталому тиску.
Рівняння ізобарного процесу у pv-діаграмі:
Р=const
У Ts-діаграмі
 ;
;
 ;
;  .
.
Зобразимо цей процес в pv–діаграмі та Ts–діаграмі:
У Ts-діаграмі це логарифмічна крива.
Співвідношення параметрів ста-ну.
 поділимо на
поділимо на
 .
.
Отримаємо:
 .
.
.
.  .
.
Теплота процесу:
 .
;
P=const;
.
;
P=const;
 .
.
Схема енергобалансу
КВП:
 ,
де
,
де
 – вільна ентальпія.
– вільна ентальпія.
КПЕ:
 .
.
Ізотермічний процес в ідеальних газах. Рівняння процесу в PV та TS координатах. Зображення процесу на PV та TS –діаграмах. Залежність для змінів параметрі стану робочого тіла. Обчислення теплоти, роботи, зміни внутрішньої енергії. Коефіцієнт перетворення енергії в процесаі (КПЕ). Коефіцієнт використання термодинамічного потенціалу в процесі (КВП).Енергетичний баланс процесу.
Ізотермічним називають процес, який протікає під час постійної температури.
Записати рівняння процесу в pv- і Ts-координатах.
pv=RT, T=const pv=const T=const
Треба зобразити цей процес у pv- і Ts-діаграмах.
У pv-діаграмі ізотермічний процес зображується як рівнобока гіпербола.
1-2 – процес розширення.
2-1 – процес стиснення.
У Ts-діаграмі це горизонтальна пряма.
Треба записати співвідношення параметрів.


Відношення тисків зворотньопропорційне відомим об’ємам.
Треба визначити зміну внутрішньої ентропії в процесі.
 ,
бо
,
бо
 .
.
Визначають зміну ентальпії у про-цесі.

Визначають зміну ентропії у про-цесі.
 Так
як
,
то:
Так
як
,
то:  .
.
Знайти теплоту процесу.
З Ts–діаграми бачимо, що:
q=площа (1-2-3-4);
 .
.
Знайдемо роботу цього процесу.
; pv=RT;  ;
;
 ;
;
 ;
;  ;
;
;
;  .
.
Зображуємо схему енергобалансу процесу.
Згідно з I законом термодинаміки:

Визначаємо коефіцієнт використання термодинамічного потенціалу в процесі (КВП).

У точці 2 термодинамічний потенціал (вільна енергія) рівний нулю:
 ;
;
 .
.
Я кщо
в ізотермічному процесі до робочого
тіла підвести меншу кількість теплоти
q`< площі
(1-2-3-4), тоді процес закінчиться у точці
2`. Тобто, не буде використаний весь
термодинамічній потенціал f,
що приведе до зменшення потужності
двигуна.
кщо
в ізотермічному процесі до робочого
тіла підвести меншу кількість теплоти
q`< площі
(1-2-3-4), тоді процес закінчиться у точці
2`. Тобто, не буде використаний весь
термодинамічній потенціал f,
що приведе до зменшення потужності
двигуна.
Знаходимо коефіцієнт перетворення енергії в процесі (КПЕ).

Це є відношення енергії направленого руху, яка отримана в процесі, до енергії хаотичного руху, яка приймала участь у цьому процесі.
Адіабатичний процес в ідеальних газах. Рівняння процесу в PV та TS координатах. Зображення процесу на PV та TS –діаграмах. Співвідношення для зміни параметрів стану робочого тіла. Коефіцієнт використання внутрішньої енергії в процесі.
Адіабатний процес
Адіабатним називають процес, який протікає без теплообміну з навколишнім середовищем.
у pv-діаграмі.
,
де k – показник адіабати.
У Ts-діаграмі:
.
У адіабатному процесі ентропія залишається незмінною.
Зображення цих процесів у pv-діаграмі – нерівнобока гіпербола.
Якщо у pv-діаграмі через одну і ту ж точку проходить адіабата і ізотерма, то адіабата йде більш круто, а ізотерма – більш полого.
 ;
; 
Адіабатичний процес в ідеальних газах.Обчислення роботи, теплоти, зміни внутрішньої енергії, ентальпії. Енергетичний баланс процесу (пояснити зміну температури робочого тіла в адіабатному процесі при розширенні і стисненні робочого тіла). Відносне розміщення ізотерми та адіабати на PV діаграмі.
 .
.  .
.  .
.
 .
.  ;
;
 ;
;  (1)
(1)
 ;
;
 ;
;
 (2)
(2)  (3)
(3)
 .
.
Підставимо
замість

 :
:  (4)
(4)
 ;
;  (5)
(5)
Схема енергобалансу.

