
- •Концепции современного естествознания
- •Материя.
- •Квантовая физика
- •Комплекс химических наук
- •Механическая форма движения материи
- •Уравнения движения (кинематические уравнения)
- •Кинетика
- •- Основное уравнение динамики
- •Механизмы
- •Физическая форма движения материи. Физическое поле.
- •Электромагнитное поле. Электричество
- •Закон Ома
- •Правила Кирхгофа
- •Магнетизм
- •Классификация сил
- •Теория относительности
- •Симметрия
Квантовая физика
Каждый колеблющийся осциллятор излучает энергию порциями или квантами.
1905 год. Альберт Эйнштейн. Фотоэффект – это выбивание электронов из вещества падающим потоком излучения. Объясняется энергией фотонов.
Артур Комптон (1892-1962гг.). В 1922 г. обнаружил и дал теоретическое обоснование эффекту изменения длины волны рентгеновского излучения вследствие рассеяния его электронами вещества, чем доказал существование фотона. За это открытие Комптон был награждён Нобелевской премией.
В 1923 Луи Де Бройль – универсальность корпускулярно-волнового дуализма. Не только фотоны, но и другие частицы обладают свойствами корпускулярными и волновыми.
Волны де Бройля — волны, связанные с любыми микрочастицами и отражающие их волновую природу. В 1929 получает нобелевскую премию за доказательство волновой природы частицы.
В 1927 году Вернер Гейзенберг – соотношение неопределенностей. Принцип неопределенности. Микрочастица не может иметь одновременно определенную координату и соответствующую проекцию импульса.
Квантовая механика описывает движение и взаимодействие микрочастиц с учетом их волновых свойств при помощи вероятностного подхода.
Квадрат модуля амплитуды волны Де Броиля определяет вероятность нахождения частицы в момент T в области с координатами X+dY, Y+dY, Z+dY.
Эрвин Рудольф Йозеф Александр Шрёдингер — австрийский физик-теоретик, один из создателей квантовой механики. Уравнение Шредингера описывает движение микрочастиц в силовых полях. Нобелевская премия. В 1945 пишет книгу, что такое жизнь с точки зрения физики.
Нильс Бор создает квантовую модель атома. 1903 год, Копенгаген.
Принцип дополнительности. Более точное определение одной из дополняющих друг друга характеристик описания объекта приводит к уменьшению точности других.
Атомы: C, O, Ca, Cl, H, N, S, Na, Cu.
Молекула — электрически нейтральная частица, состоящая из двух или более связанных ковалентными связями атомов, наименьшая частица химического вещества, обладающая всеми его химическими свойствами. Причины удержания атомов в молекулах носят электромагнитный характер.
На Земле наиболее распространены:
O,Si,Al,Fe,cu,Na,K,Mg,Ti,Mn
Химия – наука, изучающая превращения веществ, сопровождающиеся изменением их состава и/или строения.
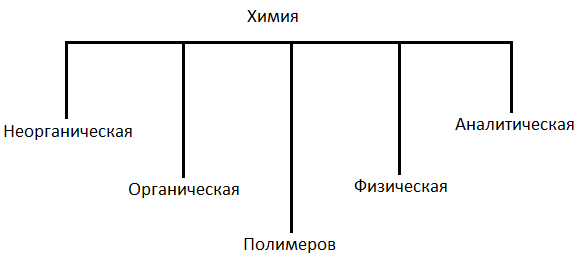
Комплекс химических наук
В состав химии входят:
Неорганическая. Изучает химические элементы и образуемые ими простые и сложные вещества (кроме соединений углеродов).
Органическая. Изучает соединения углерода с другими элементами и законы их превращения.
Физическая. Изучает причину химических явлений и их закономерности на основе общих принципов физики.
Аналитическая. Изучает методы, определения химического состава вещества.
Полимеров. Изучает вещества, у которых молекулы состоят из большого числа повторяющихся звеньев.
Полимеры – это вещества, у которых молекулы состоят из большого числа повторяющихся звеньев. По происхождению могут быть природными, биополимерами или синтетическими.
По форме могут быть линейными, разветвленными.
Кристалл – это твердое тело, атомы или молекулы образуют упорядоченную периодическую структуру.
Свойства:
Симметричность атомной структуры
Симметричность внешней формы
Анизотропия физических свойств
Анизотропия – неодинаковость свойств среды (например, физических: упругости, электропроводности, теплопроводности, показателя преломления, скорости звука или света и др.) по различным направлениям внутри этой среды; в противоположность изотропии.
28.09.2012
Неорганическая химия – химические элементы и образуемые ими простые и сложные вещества (кроме соединений углерода).
Органическая химия – соединения углерода с другими элементами (органические соединения) и законы их преобразования.
Физическая химия – причины химических явлений и их закономерности на основе общих принципов физики.
Аналитическая химия – методы определения химического состава вещества.
Полимеры – вещества, у которых молекулы состоят из большого числа повторяющихся звеньев (макромолекулы); различают биополимеры и синтетические полимеры.
Космохимия, геохимия и т.д.
Задачи химии: анализ и синтез.
Синтез (от греч. synthesis – соединение, сочетание, составление) – это целенаправленное получение сложных веществ или соединений из более простых. Методы синтеза: физические (растворение, фильтрование, выпаривание, дистилляция, электролиз) и химические (нагревание, воздействие пламенем или взрывом, получение газов при растворении).
Например, взрыв смеси углерода и водорода -> вода; сжигание угля -> двуокись углерода.
Анализ (от греч. analysis – разложение, расчленение) – это разложение сложных веществ на более простые с целью определения химического состава исходного вещества. Может быть качественный (хотим выяснить, из чего состоит данное вещество) и количественный (определение, в каких пропорциях выделяется данное вещество).
Методы анализа:
химическая реакция (наблюдение механизма и скорости протекания реакций);
оптическая спектроскопия (каждое химическое вещество обладает световым спектром);
рентгеновская спектроскопия (определяет длину волн лучей, проходящих через вещество лучей, какие поглощаются, какие испускаются);
фотоэлектронная (определяет интенсивность света) и рентген электронная спектроскопия (определяет длину волн);
резонансная спектроскопия (воздействие на вещество различными частотами, чтобы выяснить, при какой частоте вещество входит в резонанс);
дифракционные методы (как вещество рассеивает свет).
Объекты изучения химии: смеси (в смеси могут быть разные пропорции составляющих ее веществ, но атомы внутри смеси не соединяются между собой, т.е. смесь всегда можно разделить, а вещества в составе сохраняют свои свойства) и соединения (это вещества, однородные по составу в любых количествах; атомы объединяются и образуются качественно новые вещества; свойства исходных веществ полностью или частично теряются; нельзя разделить; например, вода, спирт, поваренная соль, медь).
Смеси могут быть: тонкие, грубые, молекулярные (например, воздух).
Частный случай смесей – это растворы. Могут быть: ненасыщенные (при добавлении вещество продолжает растворяться), насыщенные (вещество выпадает в осадок и получается перенасыщенный раствор), перенасыщенные; газовые, жидкие, твердые (сплавы).
Взаимное расположение молекул, расстояния между ними определяют молекулярное сцепление -> состояние вещества (газообразное, жидкое, твердое, кристаллическое). Наиболее большое молекулярное сцепление – в твердых веществах.
Химическая реакция – это превращение одних веществ в другие, отличные по химическому составу и строению.
Химические реакции характеризуются:
Соотношением участвующих в них веществ.
Степенью превращения.
Константами скорости и равновесия.
Энергией активации.
Тепловым эффектом.
Химическая реакция происходит за счет обмена электронами между атомами (наличие электронного облака). Именно этот процесс и приводит к превращению одних веществ в другие.
Химические реакции классифицируются:
По числу молекул, участвующих в реакции (мономолекулярная – участвуют молекулы одного и того же элемента, бимолекулярная – участвуют два разных элемента, полимолекулярная – участвуют два и более веществ).
По кинетическому механизму (как происходит реакция; последовательные – одно вещество переходит во второе, второе в третье и т.д., параллельные – из одних и тех же исходных молекул могут образовываться два и более вещества, сопряженные – в одном и том же растворе образуются два и более вещества, причем во взаимодействие вступают разные агрегаты).
По характеру химического процесса (разложение – одна сложная молекула распадается на несколько простых, окисление – может быть в процессе горения и ржавления, полимеризация – образование макромолекул).
По типам частиц, участвующих в превращении (йонная, радикальная [радикал – неустойчивая форма вещества, но наиболее реактивная, электронный спиновый момент равен ½], молекулярная – в основном ковалентная и водородная связь).
По фазовому или агрегатному состоянию реагирующей системы (газо фазные, жидко фазные, твердо фазные).
По области протекания реакции (гомогенные – происходят в объеме фазы, гетерогенные – происходят на области раздела фаз).
Если при создании молекулы ее энергия меньше, чем сумма энергий составляющих ее изолированных атомов, то она может существовать, т.е. ее связь устойчива.
Катализатор – вещество, которое изменяет скорость реакции, но не входит в состав конечного продукта.
Есть экзотермические (утечка тепла в окружающую среду) и эндотермические (получение тепла из окружающей среды) реакции.
C +
 =
= + 94250 Кл - сжигание угля
+ 94250 Кл - сжигание угля
2С + 2Н =
 – 56000 Кл
– 56000 Кл
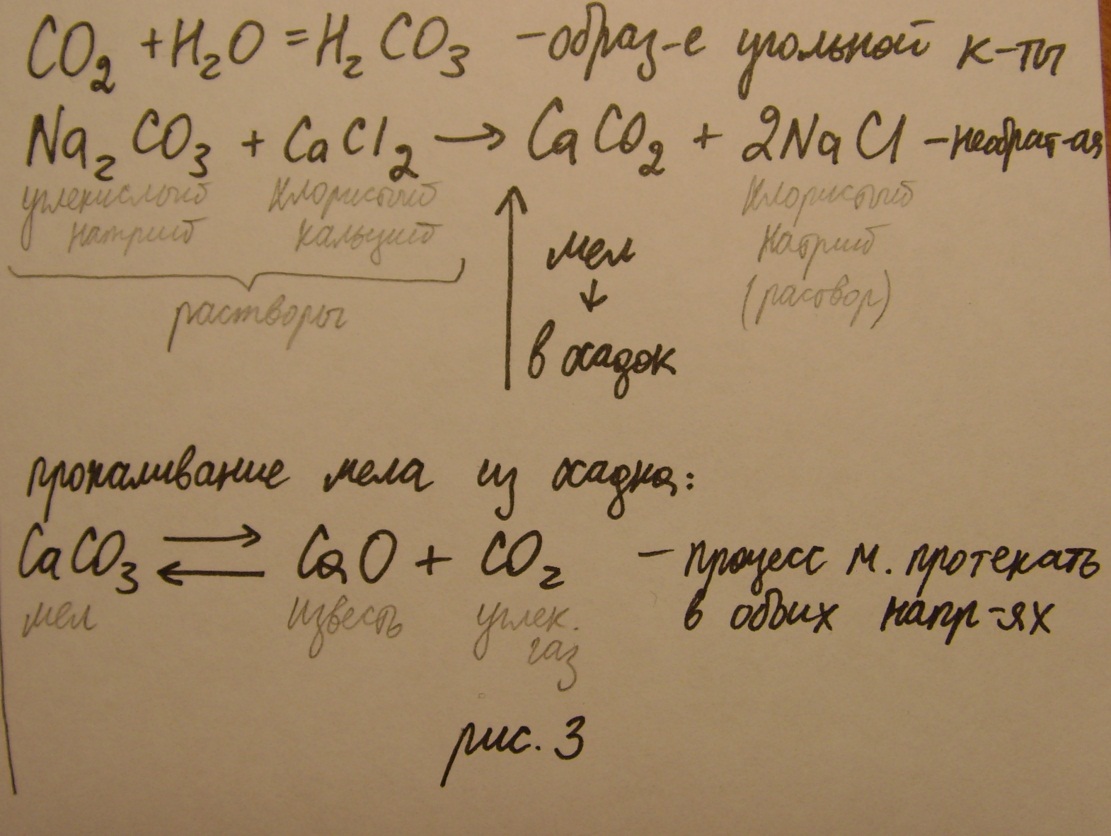
Растворение извести в воде:
CaO +
 -> Ca
-> Ca -
раствор гидроокиси Ca
-
раствор гидроокиси Ca
Продувание через нее углекислого газа:
Ca
+
->
 +
+
Химия произошла от древней науки алхимии.
05.10.2012
