
- •Ответы на билеты по химии
- •1. Периодический закон и периодическая система химических элементов д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
- •2. Предельные углеводороды
- •Строение молекулы метана
- •Разложение
- •Билет №2
- •2. Непредельные углеводороды ряда этилена (алкены)
- •1. Строение алкенов
- •Физические и химические свойства :
- •Отдельные представители
- •Билет №3.
- •1. Виды химической связи и способы ее образования в неорганических соединениях: ковалентная (полярная, неполярная, простые и кратные связи), ионная, водородная.
- •Химические свойства
- •1. Классификация химических реакций
- •2. Крахмал, целлюлоза
- •Билет 5.
- •1. Обратимость химических реакций, химическое равновесие
- •2. Ацетилен…
- •1. Скорость химических реакций
- •Катализ и катализаторы
- •2. Ароматические углеводороды (арены)
- •1. Основные положения теории химического строения а.М. Бутлерова
- •2. Электролиз как окислительно-восстановительный процесс. Электролиз как окислительно-восстановительный процесс
- •1. Изомерия органических соединений и ее виды.
- •2. Классификация оксидов
- •1. Металлы, их положение в периодической системе химических элементов д. И. Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.
- •2. Фенол…
- •2. Предельные одноатомные спирты
- •2. Жиры, их состав и свойства. Жиры в природе, превращение жиров в организме. Продукты технической переработки жиров, понятие о синтетических моющих средствах.
- •1. Кислоты, их классификация и химические свойства на основе представлений об электролитической диссоциации. Особенности свойств концентрированной серной кислоты на примере взаимодействия с медью.
- •2. Полимеры. Пластмассы: термопласты и реактопласты…
- •1. Основания, их классификация и химические свойства на основе представлений об электролитической диссоциации.
- •2. Глюкоза — представитель моносахаридов, химическое строение, физические и химические свойства, применение.
- •1. Средние соли, их состав, названия, химические свойства (взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена).
- •2. Взаимное влияние атомов в молекулах органических веществ на примере этанола и фенола.
- •1. Катализ, катализаторы, практическое применение.
- •2. Анилин
- •Физические свойства
- •Важнейшие химические свойства анилина
- •Применение
- •2. Белки
- •Структура белка
- •Физические свойства
- •Химические свойства
- •Функции белков в организме
- •Алюминий…
- •2. Многоатомные спирты
- •1. Волокна: природные и химические, их представители и применение.
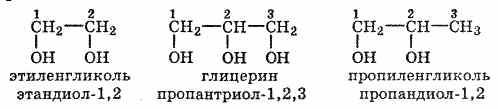
2. Многоатомные спирты
Представители многоатомных спиртов — этиленгликоль и глицерин. Двухатомные спирты, содержащие две гидроксильные группы—ОН, называются гликолями, или диолами, трехатомные спирты, содержащие три гидроксильные группы, — глицеринами, или триолами. Положение гидроксильных групп указывается цифрами, на-
Физические свойства
Многоатомные спирты — бесцветные сиропообразные жидкости сладковатого вкуса, хорошо растворимы в воде, плохо — в органических растворителях; имеют высокие )температуры кипения. Например, tкип этиленгликоля 198°С, плотность ( глицерин = 1,26 г/см3.1,11 г/см3; tкип (глицерин) = 290°С,
Получение
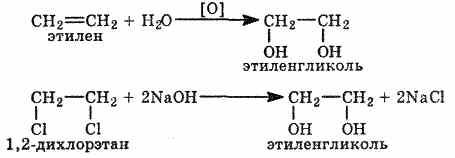
Двух- и трехатомные спирты получают теми же способами, что и одноатомные. В качестве исходных соединений могут быть использованы алкены, галогенопроизводные и другие соедине-ния. Например: Глицерин получают из жиров, а также синтетическим путем из газов крекинга нефти (пропилена), т.е. из непищевого сырья.
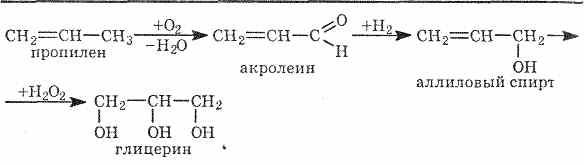
Химические свойства
Многоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп. Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется наличием в молекуле дополнительных гидроксильных групп, обладающих отрицательным индуктивным эффектом. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. Например, этиленгликоль реагирует не только с щелочными металлами, но и с гидроксидами тяжелых металлов.
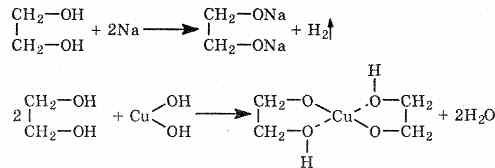
По аналогии с алкоголятами соли двухатомных спиртов называются гликолятами, а трехатомных — глицератами. При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген:
 Вторая
гидроксогруппа замещается труднее, под
действием РСl5.
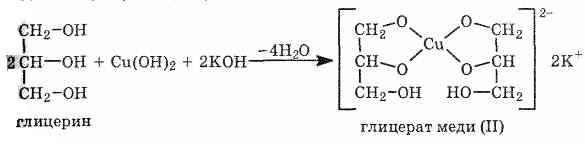
При взаимодействии
гидроксида меди (II) с глицерином и другими
многоатомными спиртами происходит
растворение гидроксида и образуется
комплексное соединение ярко-синего
цвета.
Юта реакция используется
для обнаружения многоатомных спиртов,
имеющих гидроксильные группы при
соседних атомах углерода -СH(ОН)-СН(ОН)-:
Вторая
гидроксогруппа замещается труднее, под
действием РСl5.
При взаимодействии
гидроксида меди (II) с глицерином и другими
многоатомными спиртами происходит
растворение гидроксида и образуется
комплексное соединение ярко-синего
цвета.
Юта реакция используется
для обнаружения многоатомных спиртов,
имеющих гидроксильные группы при
соседних атомах углерода -СH(ОН)-СН(ОН)-:
 В
отсутствие щелочи многоатомные спирты
не реагируют с |гидроксидом меди (II) —
их кислотность для этого
недостаточна.
Многоатомные спирты
взаимодействуют с кислотами, образуя
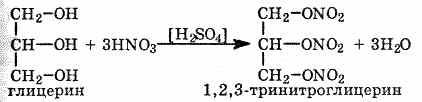
сложные эфиры (см. §7). При взаимодействии
глицерина с азотной кислотой в присутствии
концентрированной серной кислоты
образуется нитроглицерин (тринитрат
глицерина):
В
отсутствие щелочи многоатомные спирты
не реагируют с |гидроксидом меди (II) —
их кислотность для этого
недостаточна.
Многоатомные спирты
взаимодействуют с кислотами, образуя
сложные эфиры (см. §7). При взаимодействии
глицерина с азотной кислотой в присутствии
концентрированной серной кислоты
образуется нитроглицерин (тринитрат
глицерина):
 Для
спиртов характерны реакции, в результате
которых образуются циклические структуры:
Для
спиртов характерны реакции, в результате
которых образуются циклические структуры:

Применение
Этиленгликоль используется главным образом для производства лавсана и для приготовления антифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время). Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканей и в других областях народного хозяйства. Наиболее важной областью применения глицерина является производство тринитрата глицерина (неверно называемого нитроглицерином) — это сильное взрывчатое вещество, которое взрывается от удара, а также лекарство (сосудорасширяющее средство). Сорбит (шестиатомный спирт) используется как заменитель сахара для больных диабетом.
Билет 20.
