
- •1.Основные понятия химии: атом, молекула, атомная и молекулярная массы, простое и сложное вещество, химический эквивалент. Моль.
- •2. Основные законы химии.
- •3. Надеюсь начало 8 класса вам всем по силе!!!! Кислоты, основания, оксиды, соли – это всё легко
- •4. Периодический закон и периодическая система элементов д.И.Менделеева, ее структура.
- •5. Основные этапы развития представлений о строении атома и ядра. Квантово-механическая модель атома.
- •6. Квантовые числа.
- •Валентность как правило определяется s и p электронами (…..)
- •8.Емкость энергетических уровней и подуровней. Строение электронных оболочек атомов и связь периодической системы со строением атомов.
- •9. Периодически и непериодически изменяющиеся свойства элементов
- •10. Энергия ионизации атомов. Ионизационный потенциал.
- •Природа химической связи. Теория валентности. Понятие о степени окисления.
- •13 Π и σ-связи. Длина связи, энергия связи.
- •Металлическая связь.
- •17. Водородная связь. Механизм образования водородной связи.
- •Валентные возможности атомов элементов различных групп и периодов
- •20. Растворы, определение, классификация. Понятие о концентрации растворов, способы ее выражения
- •21. Теория электролитической диссоциации. Степень и константа электролитической диссоциации. Закон разведения Оствальда.
- •22.Сильные электролиты. Активность. Ионная сила растворов.
- •Слабые электролиты
- •23. Свойства воды. Вода.Водородный показатель среды.
- •24. Активность, коэффициент активности. Ионная сила растворов. Связь между коэффициентом активности и ионной силой раствора
- •25 Гидролиз солей. Константа и степень гидролиза. Факторы смещения равновесия гидролиза. Необратимый гидродиз.
- •26 Скорость химической реакции. Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Порядок и молекулярность реакций. Энергия активации, ее физический смысл.
- •Правило Вант-Гоффа
- •28 Катализ. Гомогенный, гетерогенный, ферментативный. Особенности отдельных типов катализа. Примеры.
- •Катализ - изменение скорости реакции под действием особых веществ (катализаторов)
- •Все вещества в одной Катализатор находится в
- •29 Обратимость химических реакций. Влияние концентрации, давления и температуры на химическое равновесие. Принцип Ле-Шателье. Константа химического равновесия
- •Определение и классификация электрохимических процессов. Понятие об электродном потенциале. Стандартный электродный потенциал. Уравнение Нернста для расчета потенциала металлического электрода.
- •Электролиз. Законы Фарадея. Электролиз с растворимым и нерастворимым анодом (в расплаве и в растворе). Выход по току. Практическое применение.
- •36. Коррозия. Основные виды коррозии: химическая, электрохимическая, коррозия под действием блуждающих токов. Методы защиты от коррозии. Ингибиторы коррозии.
- •37. Термодинамика и кинетика коррозии.
6. Квантовые числа.
Современная модель основана на 2 фундаментальных принципах квантовой физики. 1. электрон имеет свойства и частицы и волны одновременно (Луи-де-Бройль) 2. частицы не имеют строго определенных координат и скоростей движения. Движение электрона описывается в кантов ой механике уравнением стоячей волны, в соответствии с которым электрон в каждый момент времени может находится в произвольной точке пространства вокруг ядра. Квантово-механическая модель представляет его в виде электронного облака, окружающее ядро. Максимальная плотность облака соответствует электронной орбитали. Движение электрона на орбитали определяется значениями 4 квантовых чисел. Главное квантовое число n (энергетический уровень) – расстояние от ядра. С увеличением n энергия электрона возрастает. Число энергетических уровней = номеру периода в котором находится элемент. Максимальное число электронов определяется N=2n2. на первом электронном уровне можер разместиться не более 2 электронов, на втором – 8, на третем –18. Орбитальное квантовое число l (энергетический подуровень) обозначают буквами s (сферическая), p (гантелеобразная), d (4 лепестковая розетка), f (более сложная). Магнитное квантовое число взаимодействие электронного облака с внешними магнитными полями. Спиновое квантовое число собственное вращение электрона вокруг своей оси. Магнитное квантовое число m взаимодействие электронного облака с внешними магнитными полями. Чем сложнее форма облака тем больше вариаций в ориентации облака в пространстве. Принимает значение 2l+1. Спиновое квантовое число s собственное вращение электрона вокруг своей оси. Принимает 2 значения +1/2 и –1/2.
7 . Порядок заполнения электронных уровней и подуровней. . Принцип минимума энергии. Принцип Паули.
Правило Клечковского В.М.
Электрон заполн. Подуровень должен иметь минимально избыточной энергией по отношению к подуровню энергии.
Li 1822S1
Al18 1S22S22P63S23P63d0
K19 1S22S22P63S23P64S1
Правило Клечковского.
Заполнение идет от n+1 меньших к n+l больших
4S 3d
4+0 < 3+2 (сначала 4S, потом 3d)
2. Правило
Если суммы n+l равны друг другу, тозаполнение уровней и подуровней происходит в напр главного квантового числа k
4p
3![]()
4+1 3+2 => сначала , потом 4p
Правило Клечковского.
Если сумма n+l равных
 3d
4p 5S
3d
4p 5S
3+2 = 4+1 = 5+0
 4S
4S
Явление правила проскока электронов.
Cr24 1S2 2S2 2P6 3S2 3P6 4S2 3d4
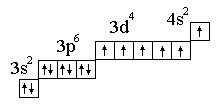
Валентность как правило определяется s и p электронами (…..)
Схема заполнения уровней и подуровней по Клечковскому.
1 S2 2S2 2P6 3S2 3P6 4S2 3d10 4p6 – 5S2 – 4d10 - 5p6 –6S2 – 5d1 – 4f4 - 5d2-10 – 6p6 – 7s2 - 6d1 –5f14 - 6d2-10 – 7p6
Принцип Паули.(на однлй молекулярной орбитале не может быть больше двух электр с антипаоралельными спинами).
Правило Гунда: Суммарный спин электронов на подуровне должен быть максимален, т.е. электроны на подуровне стремятся занять максимальное число свободных квантовых состояний.
Число неспор. электронов или свободных квантовых состояний определяется валентностью атома. В пределах электронного уровня электроны могут исходить с подуровня на подуровень.
